
A.-M.
Grimoud, M. Boulbet Mauger, J.-Ph. Lodter 2004, Critères de sélection
d’échantillons dentaires pour l’étude de l’ADN ancien. Antropo, 6, 43-51. www.didac.ehu.es/antropo
Critères de
sélection d’échantillons dentaires pour l’étude de l’ADN ancien.
Dental
samples selection for ancient DNA study.
A.-M.
Grimoud, M. Boulbet Mauger, J.-Ph. Lodter
UMR 8555
CNRS-EHESS-UPS, 37 allées Jules Guesde, 31073 Toulouse Cedex 3, e-mail :
ANNEMARIE.GRIMOUD@wanadoo.fr
Mots-clés: structure dentaire, ADN ancien,
sélection des échantillons, risques de contamination
Key words: dental structure, ancient DNA,
sample selection, contamination risk
Résumé
La
dent est un matériel de choix pour l’étude de l’ADN ancien. Néanmoins certains
critères sont requis pour limiter les risques de contaminations par d’autres
molécules d’ADN. De ce fait les paramètres limitant ce risque sont, la présence
de la dent sur l’arcade ou incluse et un apex édifié. Les facteurs de risque
étant associés, au cours de l’éruption dentaire à l’édification incomplète de
l’apex et lorsque la dent a présenté une pathologie d’origine carieuse ou
parodontale à la présence de lyse osseuse à type de fenestration.
Abstract
Teeth provide excellent material for the
study of ancient DNA. Nevertheless it is necessary to establish certain
selection criteria to limit the risk of contamination by other DNA molecules.
The risks can be considered limited when the tooth is on the dental arch or
impacted (enclosed in the jaw bone) and has a fully formed apex, as the risk
factors are associated with the apex being incompletely formed when the tooth
erupted, and with bone lesions and fenestration when caries or periodontal
pathologies were present.
1.
Introduction
La
preuve de la persistance de l’ADN après la mort d’un organisme a tout d’abord
été démontrée à partir d’échantillons de momies égyptiennes, dès 1984 (Pääbo,
1985). Les restes les plus divers, animaux taxidermisés, ossements, dents fossiles,
parchemins, ambre et même peintures rupestres, sont des milieux de préservation
de l’ADN à travers le temps.
Or
il apparaît que la dent, par sa structure et sa composition, est le fossile le
plus résistant et le plus apte à fournir des échantillons d’ADN ancien
(Woodward et al., 1994). En effet, en raison de son très haut degré de
minéralisation, la dent est souvent le seul fossile utilisable, présent sur les
sites de fouilles archéologiques ou sur un cadavre soumis à des conditions
extrêmes de conservation (Baker et al., 2001).
L’organe
dentaire abritant, au sein de la pulpe, des cellules qui contiennent de l’ADN,
elle peut être un outil de choix pour l’étude de l’ADN ancien (Sivagami et
al.,). Les champs d’application sont très larges dans les domaines de la
Médecine Légale et de l’Anthropologie. L’ADN permet en effet, le typage et
l’identification de restes humains, la détermination du sexe, l’identification
de pathologies, l’étude de la génétique des populations, des migrations ou des
origines de l’homme moderne (Drancourt et al., 1996 ; Hummel et al.,
1999 ; Di Benedetto et al., 2000 ; Vernesi et al., 2001).
Mais la
notion de “dent coffre-fort d’ADN ancien” étant dépendante de la présence de
lésions dentaires survenues ante ou post morten, nous présentons d’une part la
dent et les tissus dentaires sains comme source potentielle d’ADN ancien et
d’autre part les risques de contamination de ces tissus, par de l’ADN exogène,
en fonction de données physiologiques, pathologiques ou de détériorations du matériel
dentaire pouvant survenir au cours des différentes manipulations des
échantillons.
2.
Les tissus dentaires source d’ADN
La
dent est composée d’un tissu conjonctif, la pulpe, richement vascularisée et
innervée et protégée par des tissus minéralisés, au niveau coronaire par la
dentine et l’émail et au niveau radiculaire par la dentine et le cément (Figure
1).
L’émail,
qui recouvre les couronnes dentaires, est le tissu le plus minéralisé de
l’organisme. Il est composé pour 96 à 98% de minéraux, essentiellement de
l’hydroxyapatite (Triller, 1986). Mais il ne contient aucun élément cellulaire
et a fortiori aucune trace d’ADN. C’est un tissu qui ne se renouvelle pas.
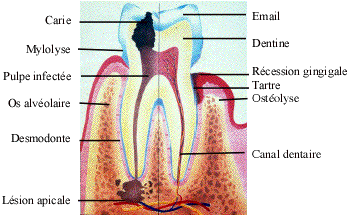
Figure 1. Tissus dentaires sains
et pathologiques
Figure 1. Dental tissus health
and pathologics
La
dentine, composée à 70% de minéraux, représente en volume le tissu dentaire le
plus important, irradié de microcanalicules, les tubulis dentinaires, allant de
la pulpe vers l’émail et le cément ; elle est recouverte par l’émail au
niveau de la couronne et par le cément au niveau de la racine de la dent
(Figure 1). L’apposition de dentine se poursuit tout au long de la vie, grâce
aux sécrétions des odontoblastes, cellules situées à l’interface dentine pulpe.
Cette apposition s’accentue, en réponse à l’agression du phénomène carieux ou
de l’usure et elle s’effectue au détriment du volume de la pulpe, seul tissu
dentaire à contenir des cellules vivantes et donc de l’ADN. La dentine contient
de l’ADN sous forme d’ADN mitochondrial au niveau des prolongements
cytoplasmiques des cellules odontoblastiques (Chomette et al., 1992).
Le
cément recouvre la dentine au niveau de la racine. Il est composé à 65% de
minéraux. Avec l’âge, mais aussi au cours de la maladie parodontale (Figure 1),
les récessions de la gencive exposent le cément à un risque accrû de caries, ce
tissu étant moins résistant que l’émail au processus de déminéralisation
(Triller, 1986).
La
pulpe assure les fonctions de nutrition, de sensibilité et de défense de la
dent ; elle est située dans la chambre pulpaire, au centre de la dentine
(Figure 1) et contient des cellules nucléées source d’ADN dont le nombre
diminue avec l’âge (Calvo et al., 2001).
L’organe
dentaire, source d’ADN, est un matériel intéressant par sa grande longévité
(Smith et al., 1993), sa résistance à des conditions extrêmes du milieu
environnant, de pression, d’humidité (Sweet et al., 1995) et notamment de
température jusqu’à 1500°C (Nossintchouk et al., 2002).
3.
Les facteurs de risques de contaminations et de modifications de la molécule
l’ADN
La
contamination de l’ADN pulpaire par de l’ADN exogène peut être associé à
différents types de lésions survenues ante morten ou post morten au cours de la
manipulation des échantillons.
3.1.
Les lésions ante-mortem
La
pathologie bucco-dentaire peut se traduire par des lésions siégeant au niveau
de la dent et/ou des tissus péridentaires pouvant être responsables de
contamination de l’ADN pulpaire. Ainsi l’atteinte carieuse, due à un
déséquilibre de l’écosystème buccal, est associée à la croissance de bactéries
cariogènes de la flore buccale commensale. Le processus carieux provoque une
déminéralisation de l’émail qui progressivement pourra atteindre la pulpe et
être à l’origine d’une solution de continuité responsable de contamination de
l’ADN. La carie induira dans un premier temps, par réaction de défense de la
dent, une apposition de dentine, au niveau de la chambre pulpaire en regard de
la lésion carieuse, qui va réduire le volume de la pulpe et donc la quantité
potentielle d’ADN exploitable et dans un second temps, une dégénérescence des
éléments cellulaires de la pulpe, et donc une perte d’ADN. En outre, en cas de
carie volumineuse, la perte de substance peut atteindre directement la pulpe,
l’ouvrir sur le milieu extérieur et l’exposer aux risques de contamination par
de l’ADN exogène (Figure 1)
Dans
le même registre, les traumatismes dentaires à type de fractures et d’usure de
la couronne dentaire (Figure 2) sont aussi des facteurs de risques de
contaminations et de destruction du tissu pulpaire. En effet, ces lésions des
tissus dentaires pourront provoquer, soit une réduction du volume pulpaire par
apposition de dentine réactionnelle, soit un risque d’effraction et d’infection
pulpaire. Dans ces conditions l’ADN sera dégradé et contaminé.
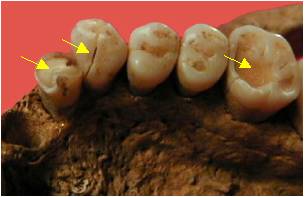
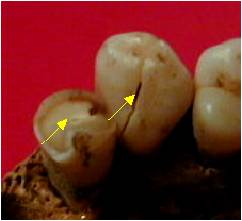
Figure 2. Dents
présentant des fractures post mortem atteignant la chambre pulpaire et des
surfaces d’usures
Figure 2. Post-mortem
teeth fractures reaching the pulp chamber and wear surfaces
La dégradation de la pulpe dentaire peut
aussi survenir lorsque l’évolution de la maladie parodontale (Figure 1)
provoque une récession de gingivale et une ostéolyse de l’os alvéolaire. Le
cément radiculaire alors découvert et exposé transmet de façon accrûe les
variations thermiques à la pulpe. La réponse pulpaire à cette agression, par
une apposition de dentine entraînera une réduction du volume tissulaire et donc
de la quantité d’ADN. Lorsque les lésions parodontales atteignent l’apex de la
dent et le foramen du canal pulpaire, la pulpe subira a retro un processus de
destruction et de contamination.
En
fait, quelle qu’en soit l’origine, l’envahissement du périapex peut se traduire
par la formation de fenestrations osseuses (Figure 3), source potentielle de
contamination exogéne.
La déhiscence de la paroi alvéolaire
(Figure 4), due à la labilité du tissu osseux, en raison de sa faible épaisseur
au niveau de la paroi vestibulaire du bloc incisivo-canin, peut également
atteindre l’apex de la dent et provoquer a retro la gangrène du tissu pulpaire.
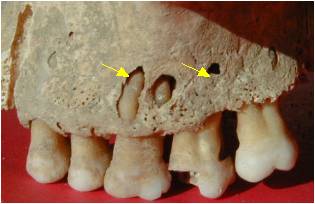
Figure 3. Fenestration maxillaire en relation avec une
infection apicale due à une lésion carieuse
Figure 3. Maxillary lesion in relation with tooth apex infection induced by caries
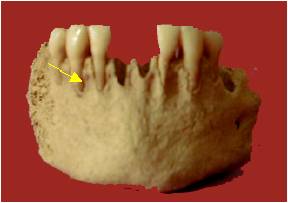
Figure 4. Lyses osseuses
mandibulaire
Figure 4. Mandibular bone lesion
3.2.
Les risques post-mortem
Le
risque post-mortem de contamination de l’ADN de la pulpe dentaire par de l’ADN
exogène peut provenir du milieu environnant et ceci d’autant plus qu’il s’agira
de sépultures multiples ou de spécimens très exposés. Le degré de contamination
sera d’autant plus élevé que le foramen apical sera largement ouvert. La dent
n’est plus alors le coffre-fort hermétiquement clos qui protège l’ADN pulpaire.
Cette ouverture sera d’autant plus réduite que le sujet est âgé. Ainsi chez
l’enfant, les racines en cours d’édification présentent un apex largement
ouvert et sont plus exposées aux risques de contamination (Figure 5).
Par
ailleurs, les tubuli dentinaires, perméables au milieu environnant,
représentent aussi une solution de continuité source de contamination de l’ADN
pulpaire. Ce risque est réduit pour les dents incluses dans le tissu osseux.
Au cours du temps, les tissus
durs de la dent deviennent fragiles, cassants et de ce fait seront facilement
exposés aux risques de fractures qui mettront la chambre pulpaire en
communication avec le milieu extérieur (Figure 6).

Figure 5. Apex non
édifié présentant un large orifice apical
Figure
5.
Incompletely formed apex
Figure
6.
Dents présentant des fractures post-mortem atteignant la chambre pulpaire
Figure 6. Post mortem teeth fractures reaching the pulp chamber
4.
Critères de sélection des organes dentaires
La
connaissance des différents facteurs de risques de contamination de la pulpe
permet d’établir des critères de sélection des dents pour analyse de l’ADN
ancien.
4.1.
Critères d’exclusion
En
fonction, des facteurs de risques d’exposition du tissu pulpaire au milieu
environnant, les critères d’exclusion concerneront, d’une part les dents
présentant, une mylolyse, une carie (Figure 7), un apex incomplètement édifié
(Figure 5), une fracture ou une usure de la couronne (Figure 2) et d’autre
part, les lésions à type de fenestration osseuse ou consécutives à une lésion
parodontale (Figures 3 et 4).
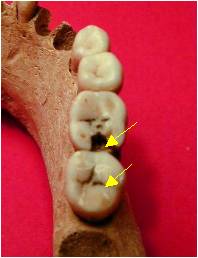
Figure 7. Lésions carieuses des
sillons et occluso-distale
Figure 7. Carious lesions of
grooves and occlusal-distal opening
4.2.
Critères d’inclusion
Le
principal critère d’inclusion est la présence de la dent sur l’arcade (Figure
8) ou incluse dans le tissu osseux (Figure 9). L’apex sera édifié (Figure.10)
et sans contact avec le milieu environnant.
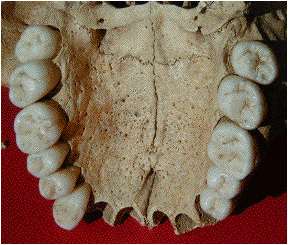
Figure 8. Dents sur
l’arcade
Figure 8. Dental arch
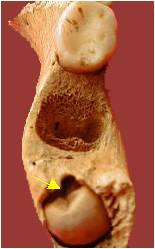
Figure 9. Dent incluse
mandibulaire
Figure 9. Mandibular
enclosed tooth

Figure 10. Apex édifiés
présentant les orifices des canaux dentaires
Figure 10. Fully formed
apices showing root canal orifices
5.
Recueil aseptique des échantillons
Les
risques de contamination sont présents à tous les stades de manipulation de
l’ADN ancien, des fouilles à l’analyse au laboratoire. L’ADN moderne des
manipulateurs, plus long et moins altéré que l’ADN ancien, sera en effet,
préférentiellement amplifié par la réaction de polymérisation en chaîne (PCR).
Les risques de contamination seraient, diminués si le port systématique de
masques et de gants pouvait être appliqué lors des fouilles et mieux identifiés
si le typage de l’ADN de tous les intervenants était réalisé.
Toutes les étapes du recueil des échantillons de pulpes dentaires doivent donc s’effectuer dans des conditions d’aseptie (décontamination des surfaces, émissions de rayons U.V., sens de circulation des échantillons pour éviter les contaminations croisées...) (Calvo et al., 2001).
Afin
de limiter les risques de contamination au moment du prélèvement les organes
dentaires, sur l’arcade, peuvent être prélevés soit par avulsion et ceci sans
dommage pour la dent si la technique est maîtrisée (Calvo et al., 2001)., soit
par fraisage de l’os alvéolaire sous irrigation ; le choix de cette
méthode est souvent préféré à l’avulsion qui risque de léser la dent (Sweet et
al., 1995).
En
ce qui concerne le recueil de la pulpe dentaire, il est impératif avant tout
d’éviter de surchauffer l’ADN. Plusieurs méthodes de recueil d’échantillons
sont décrites, il s’agira (1) de la méthode par fracture (Figure 11), fracture
précédée de l’incision de la surface dentaire avec un disque diamanté stérile,
réalisée à l’aide d’un syndesmotome introduit dans le trait d’incision et
suivie du recueil du tissu pulpaire à l’aide d’une sonde dentaire (Calvo et
al., 2002) ; (2) de la méthode par broyage de la totalité de la dent
(Baker et al., 2001), (3) de la technique par recueil endocanalaire (Figure
12), les tissus pulpaires sont alors prélevés à l’aide d’un instrument
introduit par voie coronaire dans la chambre et le canal pulpaire.
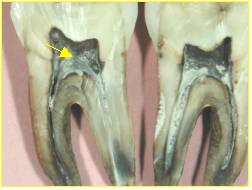
Figure 11. Recueil de
pulpedentaire sur dent sectionnée
Figure 11. Tooth broken before
dental pulp sample collection
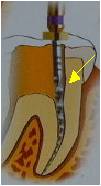
Figure
12. Recueil endocanalaire dentaire de pulpe dentaire
Figure 12. Endodontic
dental pulp sample collection
Quel
que soit le mode de recueil des échantillons de pulpe dentaire, le dénominateur
commun est, la manipulation toujours soumise aux règles de l’asepsie. Le
prélèvement de tissu pulpaire, comme source d’ADN ancien, peut être dans ces
conditions analysé en biologie moléculaire, en particulier en utilisant la
technique de réaction de polymérisation en chaîne (PCR). Cette méthode permet
en effet, en amplifiant les brins d’ADN ancien de rendre exploitable la faible
quantité d’ADN présent dans les spécimens prélevés (Di Benedetto et al., 2000).
6.
Conclusion
Avant
toute investigation, dans le domaine d’analyse de l’ADN ancien extrait de
pulpes dentaires, il paraît essentiel pour sélectionner un échantillon
dentaire, de se référer aux données anatomiques et paléopathologiques et de préciser
en conséquence l’état du matériel utilisé. Les critères d’inclusion et
d’exclusion garantissent, au minimum, l’impact des nombreux risques de
contamination exogène ou de détérioration de l’ADN pouvant entraver son
analyse. En raison des difficultés inhérentes à l’exploitation de l’ADN ancien
tant en médecine Légale qu’en Anthropobiologie une coopération
pluridisciplinaire permettrait de mieux appréhender les différents paramètres
source de handicap de l’étude de l’ADN ancien. C’est dans cette dynamique de
partenariat que nous nous inscrivons.
Les
photos ont été réalisées par l’auteur à partir de la collection de Saints Côme
et Damien
Bibliographie
Baker, L.E., Mc Cormick, W.F.,
Matteson, K.J., 2001. A silica-based mitochondrial DNA extraction method
applied to forensic hair shafts and teeth. Journal of Forensic Sciences, 46,
126-130.
Calvo, L., Kheyser, C., Grimoud, A.M.,
Ludes, B., Pajot, B., Lodter, J.P., 2002, Schémas d’incision et de fracture des
différents morphotypes de dents adaptés au recueil de pulpes dentaires et à
l’analyse d’ADN, Bull. et Mém. de la Société d’Anthropologie de Paris, 13,
121-128.
Chomette, G., Auriol, M., 1992,
Histologie du complexe dentino-pulpaire. Paris: Editions Techniques -EMC,
Stomatologie et odontologie, 22-007-B10, 13p.
Di Benedetto, G., Nasidze, I.S.,
Stenico, M.), Nigro, L., Krings, M., Lanzinger, M., Vigilant, L., Stoneking,
M., Paabo, S., Barbujani, G., 2000, Mitochondrial DNA sequences in prehistoric
human sequences in prehistoric human remains from the alps. European Journal of
Human Genetic, 8, 669-677.
Drancourt, M., Aboudharam, G.,
Signoli, M., Dutour, O., Raoult, D., 1998, Detection of 400-year-old Yersinia
pestis DNA in human dental pulp : An approach to the diagnosis of ancient
septicemia. Proc. Natl. Acad. Sci. USA, 95, 12637-12640.
Hummel, S., Schultes, T.,
Bramanti, B., Herrmann, B., 1999, Ancient DNA profiling by megaplex
amplifications. Electrophoresis, 20, 1717-1721.
Nossintchouk R.M., 1985, Manuel
d’odontologie médico-légale (Paris : Masson), pp 213.
Pääbo S., 1985, Molecular cloning of
ancient egyptian mummy DNA, Nature 314, 644-645.
Sivagami
A.V., Rajeswarao, A., Varshney U., 2000, A simple and cost-effective method for
preparing DNA from the hard tooth tissue, and its use in polymerase chain reaction
amplification of amelogenin gene segment for sex determination in an indian
population. Forensic Science International, 110, 107-115.
Smith, B.C., Fischer, D.L., Weedn, VW.,
1993, A systematic approach to the sampling of dental DNA. Journal of Forensic
Sciences, 38, 1194-1209.
Sweet, D., Sweet, Ch., 1995, DNA Analysis
of dental pulp to link incinerated remains of homicid victim to crime scene.
Journal of Forensic Sciences, 40, 310-314.
Triller, M., 1986,
Histologie dentaire. (Paris : Masson), pp.210.
Vernesi, C., Di
Benedetto, G., Secchieri, E., Simoni, L., Katti, E., Malaspina, P., Novelleto,
A., Marin, V.T., Barbujani, G., 2001, Genetic characterization of the body
attributed to the evangelist Luke. Proc Natl Acad Sci USA, 98, 13460-3.