Bernis, C., 2004,
Envejecimiento, poblaciones
envejecidas y personas ancianas. Antropo, 6, 1-14. www.didac.ehu.es/antropo
Artículo
de revisión – Review article
Envejecimiento,
poblaciones envejecidas y personas ancianas
Aging, aged populations
and elderly persons
Cristina Bernis
Catedrática de Antropología.
Departamento de Biología. Universidad Autónoma de Madrid. España
1. Introducción
El envejecimiento es un proceso multifactorial que tiene
lugar durante la última etapa del ciclo vital y que se caracteriza por la
disminución progresiva de la capacidad funcional en todos los tejidos y órganos
del cuerpo, y de la consiguiente habilidad de ajustarse a estímulos ambientales
(Figuras 1 y 2).
Se consideran poblaciones envejecidas aquéllas en las que
existen proporciones elevadas de personas mayores de 65 años. En su conjunto, Homo
sapiens no es una
especie muy envejecida, aunque
probablemente lo sea en un futuro próximo (en el año 2000, un 8% de personas
era mayor de 60 años y en el 2025
lo será el 16%).La distribución no es homogénea ni entre países, ni entre
sexos, ni entre sectores sociales diferentes de un mismo país; las poblaciones
más envejecidas se encuentran en los países occidentales y Japón, y las que
menos en los países en desarrollo.
Entre los ancianos hay más mujeres y más población de sectores sociales
favorecidos. La variabilidad en el nivel de envejecimiento poblacional se debe
a la mortalidad y la fertilidad diferenciales. El control de la mortalidad
infantil permite que cada vez más personas lleguen a edades avanzadas, mientras
que el control de la fertilidad reduce los primeros escalones de la pirámide
poblacional, aumentando la proporción absoluta y relativa de ancianos; la combinación de ambos fenómenos
aumenta la proporción de ancianos (Tabla 1).
Independientemente del grado de envejecimiento poblacional,
el número absoluto de ancianos ha crecido de manera espectacular en todas las
poblaciones del mundo; de hecho, dos tercios de los 600 millones de ancianos se
concentran en el mundo en el desarrollo, especialmente en China e India, que
mantienen poblaciones todavía jóvenes.
Esta población creciente de ancianos representa una situación
biosocial nueva en la Historia de nuestra especie, y requiere un conocimiento profundo del proceso de
envejecimiento, de su variabilidad en diferentes circunstancias ambientales, de
las singularidades del envejecimiento en hombres y mujeres, del control
genético del proceso y de la influencia de los estilos de vida para conseguir
vivir más años y vivirlos en buena salud. A principios del siglo XXI las bases
de las políticas sanitarias,
sociales, económicas y de investigación deben estar coordinadas y enfocadas a
borrar las desigualdades, a
retrasar los síntomas de envejecimiento, a conseguir un etapa final de
la vida más libre de discapacidades y de enfermedades, y a mantener una red de
apoyo sanitario, social y afectivo adecuado.
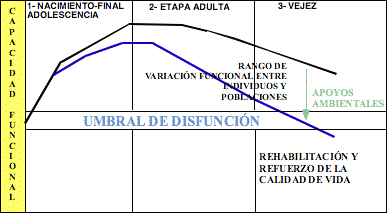
Figura 1. Represenación de la pérdidad de capacidad funcional a lo largo del ciclo vital. El nivel de máxima funcionalidad alcanzado en etapas tempranas, y la edad cronológica a la que se alcanza, detrminana respectivamente la capaidad funcional en la vejez, y su velocidad de pérdida.
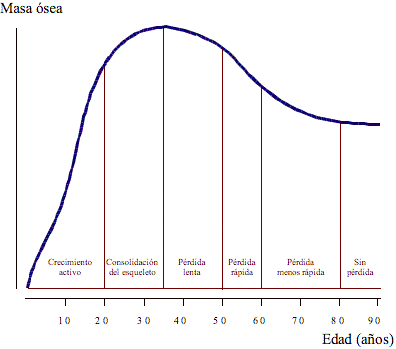
Figura 2. La cantidad de mása ósea conseguida hasata los 35 años, la actividad física que se
realiza, y en parte el contenido en Ca de la dieta, determina la velocidad de
pérdida , la situación en la que se estabiliza la pérdida de masa ósea , por
encima o por debajo de la línea de fractura.
|
País |
% Mayores
de 65 años |
Tasa global de fecundidad |
% Supervivientes (lx) a los: |
H EV0 |
M EV0 |
Edad mediana muerte (H+M) |
Mort. infantil (‰) (H+M) |
|||
|
|
|
|
65 años |
80 años |
|
|
|
|
||
|
|
|
|
H |
M |
H |
M |
|
|
|
|
|
Afganistan |
3 |
6,5 |
33,6 |
38,5 |
9,1 |
12,2 |
44,1 |
45,0 |
2 |
154 |
|
Nigeria |
3 |
6,3 |
38,4 |
44,3 |
11,1 |
16,1 |
49,8 |
51,4 |
7 |
75 |
|
Pakistan |
4 |
2,1 |
46,5 |
35,1 |
31,4 |
24,3 |
60,1 |
60,7 |
7 |
91 |
|
Papua N. G. |
4 |
|
47,0 |
51,1 |
15,6 |
22,7 |
55,1 |
57,4 |
22 |
69 |
|
La India |
4 |
4,6 |
53,8 |
17,6 |
62,2 |
18,7 |
59,7 |
62,8 |
37 |
70 |
|
Indonesia |
4 |
|
60,8 |
72,1 |
21,6 |
57,3 |
63,3 |
67,4 |
47 |
46 |
|
China |
7 |
1,8 |
59,1 |
69,5 |
43,4 |
46,1 |
68,8 |
72,9 |
64 |
31 |
España
|
17 |
1,6 |
81,3 |
92,1 |
45,8 |
69,5 |
75,3 |
82,3 |
75 |
4.9 |
|
Suecia |
17 |
1,8 |
85,9 |
90,8 |
50,9 |
67,2 |
77,3 |
81,9 |
78 |
3.4 |
|
Japón |
17 |
1,5 |
84,3 |
92,7 |
52,6 |
75,1 |
77,5 |
84,3 |
78 |
3.4 |
|
EEUU |
|
1,9 |
77,9 |
86,4 |
42,6 |
57,9 |
73,9 |
79,4 |
74 |
7 |
|
Total Homo sapiens |
7 |
3,6 |
|
|
|
|
65 |
69 |
55 |
56 |
Tabla 1. Proporción de personas mayores de 65. Sobrevientes
(lx), a los 65 años y a los 80
años. Esperanza de vida al nacer en hombres y en mujeres, y mortalidad infantil
en algunos países del mundo y en el conjunto de nuestra especie en 2001. (La
edad mediana de muerte corresponde a 1990.)
2. Ciclo vital, envejecimiento y longevidad
El ciclo vital es una característica especifica, definida por
una duración potencial máxima entre la concepción y la muerte y una serie de etapas durante las que tienen lugar los
procesos ontogenéticos
—crecimiento, desarrollo, maduración e involución. Los procesos
ontogenéticos, la secuencia en que
ocurren y su expresión fenotípica están genéticamente programados y
ambientalmente limitados. La expresión de los genes que determinan las
características bioquímicas, somáticas y cognitivas que singularizan nuestros
ciclo vitales requiere el aporte constante de energía y materia para poder
mantener las funciones vitales, además de mecanismos de protección frente a
factores ambientales que, como las radiaciones o los productos acumulados del
metabolismo celular o de errores de codificación, pueden dañar la
estabilidad y alterar la expresión
génica. La expresión secuencial y diferencial de un mismo conjunto de genes en
ambientes concretos origina el continuo de fenotipos sucesivos que corresponden
a un mismo individuo a lo largo de su ciclo vital, es decir, “Somos un ciclo
vital” (Bonner, 1993) . Lo que ocurre en cada etapa está condicionado por lo
que ha ocurrido en las anteriores, de manera que la acción de factores
limitantes del medio en etapas tempranas del ciclo vital pueden tener
consecuencias a largo plazo sobre el proceso de envejecimiento, por ejemplo,
algunas evidencias sugieren que la aceleración en los proceso de desarrollo se
acompañan de un inicio más temprano de los proceso involutivos, y otras, que el riesgo de padecer
algunas enfermedades en la vejez se asocia con situaciones de deprivación
ambiental en las etapas tempranas (Barker 1993 y 1996; Cameron y Demethat,
2002; Lucas, 1994).
La capacidad que
tiene un mismo genotipo de expresarse de manera diferencial en función de las
condiciones ambientales en las que viven los individuos se llama
ecosensibilidad, y es el resultado de respuestas o ajustes biológicos a través
de los factores hormonales y de reguladores metabólicos de la energía (Bernis,
2003 y 2004); cuando estas respuestas tiene lugar en las etapas tempranas del
ciclo se suele denominar plasticidad, muy característica de los mamíferos
(Pigliucci, 2001).
Los procesos involutivos asociados al envejecimiento se
manifiestan a nivel molecular, celular y funcional con una expresión evidente
en el fenotipo visible. Utilizando indicadores de estos cambios moleculares, morfológicos, fisiológicos,
funcionales y conductuales se obtiene una visión global del proceso. Es
difícil, sin embargo, definir “envejecimiento normal”, debido tanto a la
ausencia de sincronía en el inicio y velocidad de los procesos involutivos
entre los diferentes tejidos y órganos corporales, como a la enorme
variabilidad individual y poblacional que existe en estos aspectos y en su
asociación con la enfermedad. Se ha definido “envejecimiento satisfactorio”
como aquél en el que se retrasan los cambios involutivos, en el que la
alteración de estructuras corporales y la
pérdida de las capacidades funcionales es más lenta y que, además, se
mantiene libre de problemas y enfermedades discapacitantes o que aumenten el riesgo
de muerte (Rowe y Kahn, 1987).
La longevidad es la capacidad de desarrollar ciclos vitales
largos, y puede aplicarse a especies, a individuos y a poblaciones. El hombre y los elefantes son especies longevas. Aplicado a individuos
se entiende como la capacidad de algunos miembros de una especie para aproximarse más que otros a la duración
potencial que tienen fijada como especie, y se mide por la edad de muerte. En Homo
sapiens esta
duración se estima en torno a 100+15 años, por lo que se consideran
longevos a los individuos (hombres y mujeres) que sobrepasan los 85-90 años; en
Pan troglodytes
la duración potencial de su ciclo es de unos 60 años, por lo que se considera
longevo un chimpancé que sobrepasa los 50.
La longevidad de las poblaciones depende del porcentaje de sus
miembros que se aproximen a la
duración potencial que caracteriza a cada especie. Esta capacidad
específica de desarrollar ciclos longevos puede ser saboteada por factores ambientales que producen
muertes en etapas tempranas o medias del ciclo vital; así, por ejemplo, la mortalidad infantil por
enfermedades infecciosas y nutricionales reduce extraordinariamente la tasa de
supervivientes hasta edades avanzadas en poblaciones. El control de
determinantes ambientales como la nutrición y la enfermedad, y la ausencia de
situaciones de guerra, genocidio y bloqueos económicos determinan un aumento del número
de personas que llegan a edades avanzadas. En los humanos la esperanza de vida
al nacer y la edad mediana de muerte se utilizan como indicadores de longevidad. La esperanza de vida al
nacer se calcula en función del numero de sobrevivientes en cada grupo de edad,
y presenta una gran variabilidad temporal geográfica y sexual en función de
condiciones ecológicos.
La esperanza de vida ha oscilado entre 20 y 50 años durante
la mayor parte de nuestra historia como especie, aumentando de manera
exponencial y mantenida a partir del inicio del siglo XX —a excepción de
situaciones puntuales de contiendas civiles o mundiales, o la gran pandemia de
la gripe del 1918. En las poblaciones no occidentales el aumento en esperanza
de vida ha sido más tardío, más variable y menos sostenido, y para las
poblaciones del Africa Subsahariano la tendencia a aumentar se invierte a
partir de los años 80 con la extensión del SIDA, que en algunos países ha
reducido en 20 años la esperanza de vida de las poblaciones. Los países del
Este de Europa, especialmente los que formaban parte de la antigua Unión
Soviética, tuvieron también un retroceso en su esperanza de vida al nacer tras el
fín de los sistemas socialistas, pero que está siendo gradualmente remontada
(Notzon et al.,
2001).
En resumen,
podemos decir que la duración potencial del ciclo vital de Homo
sapiens no ha
variado desde hace al menos 100.000 años, que su duración real (medida por la
esperanza de vida al nacer) ha oscilado entre 20 y 50 años en función de las
condiciones del medio, y que a comienzos del siglo XX, al controlarse
eficazmente la mortalidad infantil, cada vez más humanos aproximan la duración
real de su ciclo vital a la potencial que tiene como especie, aumentando así el
número de longevos en las poblaciones.
Todo ello implica que la vejez es una característica de
nuestra especie y que en todas las épocas y condiciones ecológicas ha habido
personas ancianas, si bien la novedad actual es el gran aumento —absoluto y
relativo— de ancianos debido al control de la mortalidad en edades tempranas,
pero sobre todo por la extraordinaria reducción de la natalidad.
3. ¿Porqué envejecemos?
El control genético del ciclo vital es un proceso
diferencial, secuencial y coordinado, durante el cual ocurren fenómenos de
activación/represión génica que dan lugar al conjunto de rasgos bioquímicos,
fisiológicos, histológicos, morfológicos y conductuales que caracterizan a cada
individuo en diferentes momentos de su ciclo vital Algunos genes, como los homeobox —implicados en diferenciación y
regionalización— son activos en periodos muy limitados en el desarrollo. Otros
tienen periodos alternantes de actividad /represión, como los implicados en
regulación de la GnRh, que determinan una producción intensa de gonadotropinas
entre la etapa perinatal, reprimiéndose hasta el inicio de la pubertad, en que
se activan de nuevo. Algunos genes, como el de la telomerasa, son activos
durante la mayor parte del ciclo vital, y se reprimen permanentemente en la
vejez —los telómeros alcanzan un numero crítico de bases (entre 4 y 6).
Finalmente otros genes permanecen
activos hasta el final construyendo proteínas plásticas y funcionales que
forman parte de nuestro cuerpo, como los que codifican para los grupos
sanguíneos. El “programa”
determina tanto la expresión de genes que regulan las características
específicas que nos identifican como Homo sapiens, como las características
bioquímicas, morfológicas y
cognitivas resultantes de polimorfismos en esos loci comunes, que nos hacen individuos singulares de la especie
(Hirvonen, 1995).
El principal mecanismo de modificación de la expresión génica
que funciona a lo largo del ciclo vital es la metilación del ADN, que tiene
funciones múltiples, de manera que interviene en la diferenciación celular, en
la impreganción genética, en la inactivación del cromosoma X en la supresión de
ADN parásito, en la supresión del ruido transcripcional y en la estabilidad de
la estructura de la cromatina (Richardson, 2003). A medida que se avanza en el
ciclo vital aumentan los “fallos en la expresión génica” por hiper o
hipometilación; la reducción de la expresión génica puede disminuir la
“cantidad” de proteínas, desde aquéllas que forman parte del paquete muscular,
hasta enzimas diversos implicados en funciones básicas, como las participantes
en los mecanismos de reparación de ADN o en la eliminación de productos
metabólicos oxidados. La hipermetilación, puede activar genes relacionados con
cáncer.
3.1.
¿Porqué se para el ‘reloj’ de la
edad?
En el desarrollo de la ontogénesis intervienen también genes
de acciones múltiples,
simultáneas o sucesivas en el tiempo (pleiotrópicos), algunos de los
cuales pueden tener una acción beneficiosa en etapas tempranas del desarrollo,
pero consecuencias negativas en etapas finales del ciclo vital (pleiotropía
antagonista), y cuyo papel se considera crucial en el envejecimiento (Williams,
1957; Hamilton, 1966, Woods et al , 1994). El control genético de la síntesis de la telomerasa
es un buen ejemplo de gen pleiotrópico antagonista.
Las células tiene un número limitado de divisiones mitóticas
que, una vez alcanzado, conducen a su muerte (Hyflic, 1980 ), de manera que se
sugirió la existencia de un “reloj mitótico” que regula el número de divisiones
que pueden tener lugar antes de la muerte celular (Harley 1991). El número de
divisiones mitóticas depende de la longitud de los telómeros y de la velocidad
de perdida de las secuencias. Los telómeros son los extremos cromosómicos, no codificadores y con secuencias muy
conservadoras de bases que aparecen con los vertebrados hace unos 400 millones
de años, y cuya misión es estabilizar al cromosoma durante la mitosis, evitando
que se pierdan secuencias básicas. En todas las células del organismo salvo las
embrionarias indiferenciadas, los gametos, y algunas cancerígenas, tras cada
división mitótica se pierden un número variable bases teloméricas según los
tejidos. Se ha estimado una media de 12 a 15 kilobases por año (Allsopp et
al., 1992). En la
mayor parte de las células somáticas con envejecimiento “normal” la actividad
de la telomerasa está reprimida y, por tanto, la división celular se suprime.
Se ha sugerido que en estas células se activa un gen supresor de tumores (el p53), que bloquea la proliferación
celular, protegiendo contra el cáncer en etapas tempranas y medias de la vida,
pero haciendo inevitable el envejecimiento. Es decir, la regulación génica de
la telomerasa permite explicar el envejecimiento celular por pleiotropía
antagonista, de manera que la
acción beneficiosa temprana del gen sería mantener libre de cáncer somático a
los individuos durante el desarrollo y la
reproducción, mientras que el coste sería el envejecimiento celular, el
aumento de riesgo de tumoración y la muerte en etapas avanzadas del ciclo
vital.
El hombre, como los demás mamíferos, dispone de complejos
sistemas reguladores, algunos de los cuales son responsables de su gran
longevidad, mediando en su más lenta tasa metabólica, mientras que otros son
sistemas de protección para mantener la homeostasis frente a cambios del
ambiente interno y externo durante nuestro prolongado ciclo vital, como
son la detoxificación, la reparación
o el sistema inmune. Todos estos sistemas se relajan con la edad cronológica, y
determinan que se acumulen cantidades importantes productos tóxicos resultantes
de fallos en estos mecanismos, o que se reduzca la inmunoprotección.
De hecho, se ha definido el envejecimiento como el proceso
resultante de una protección imperfecta de los principales componentes
celulares frente a los radicales libres producidos durante el metabolismo
aeróbico normal en la cadena respiratoria mitocondrial (Harman 1993), de manera que el envejecimiento
se produce por acumulación de daño en tejidos somáticos, especialmente a partir
del momento en que la capacidad reproductora disminuye, cuando el coste de
mantener en “buen estado” sistemas de reparación relativamente eficaces es
mayor que la ventaja reproductora (Kirkwood, 1977 y 2002). El daño
macromolecular, incluido el que se produce en el ADN, y la inestabilidad
genómica se interpretan así por muchos autores como las fuerzas determinantes de los procesos
involutivos y de enfermedades relacionadas. La acumulación de productos de
gliocosación no enzimática tienen consecuencias semejantes.
3.2.
Radicales libres, productos de glicosilación no enzimática y envejecimiento
El
oxígeno molecular es fundamental para el metabolismo energético y la producción
de energía, pero también produce restos muy reactivos que pueden dañar los
tejidos. Cada célula del organismo humano está expuesta cada día a unos 10.000
impactos oxidativos (Rusting, 1995). Durante las primeras etapas del ciclo
vital, el 1% del oxígeno utilizado en las mitocondrias se transforma en
radicales libres, que se limpian con bastante eficacia hasta llegar a la
edad mediana, cuando comienzan a fallar los mecanismos de limpieza. Se plantea también
que pequeñas cantidades de los radicales libres de oxígeno pueden tener una
cierto papel en la regulación de la expresión génica durante las etapas previas
a la vejez. El ADN-mitocondrial codifica para una docena de proteínas que la
mitocondria necesita para su funcionamiento; su capacidad para generar energía
disminuye con la edad, a causa de los radicales libres, ya que las mitocondrias
son la principal fuente de radicales libres en el organismo y el
ADN-mitocondrial es especialmente vulnerable a la agresión oxidativa porque
carece de histonas.
Además
del transporte mitocondrial de
electrones, las fuentes más importantes de radicales libres de oxígeno son el
metabolismo de peroxidación de
ácidos grasos, las reacciones del citocromo P450, y las células fagociticas (respiratory burst), aunque también existen numerosos enzimas capaces de
originar ROS tanto bajo condiciones normales, como patológicas. Se ha sugerido
que las principales dianas atacadas por los radicales libres son las membranas
celulares y el genoma. El genoma nuclear y el mitocondrial son especialmente
vulnerables frente al daño producido por la acumulación de radicales, y el
envejecimiento resulta por acumulación de este daño no reparado. Recientemente
se ha sugerido que el oxido nítrico (generado por la enzima
nitrico-oxido-sintetasa) y otros óxidos del nitrógeno conocidos como radicales
libres de nitrógeno (RNS) pueden contribuir a la peroxidación de lípidos (Drew
y Leuwenburg 2002), que aumenta con la edad. Aunque su papel en el proceso de
envejecimiento no está demostrado (Balazy y Nigam, 2003), es interesante
recordar que las membranas celulares del sistema nervioso son muy ricas en
lípidos y por tanto sensibles al ataque de ROS.
Algunos autores consideran que el envejecimiento, puede ser
resultado también de metabolismo alterado de la glucosa por glicosilación no
enzimática (Cerami et al., 1995). La glucosa es el azúcar menos reactivo de nuestro
organismo, pero el más abundante,
por lo que tiene mayor efecto potencial sobre las proteínas. La glucosa
se une normalmente a las proteínas en un lugar específico sobre moléculas
determinadas y con un fin concreto; esta unión funcional se llama “unión
enzimática”. Existen uniones no
enzimáticos, llamadas “reacciones de Maillard” o de “oscurecimiento”, que
añaden glucosa al azar sobre cadenas polipeptídicas; esto desencadena una serie
de reacciones químicas que culminan en la formación y acumulación de enlaces
cruzados entre moléculas proteicas próximas. Inicialmente son productos inestables,
pero se transforman en los llamados productos Amadori, de naturaleza más
estable, que se deshidratan lentamente
dando lugar a formas irreversibles conocidas como “productos finales de
glicolisación avanzada” (PFGA), que parece juegan un papel importante en los
procesos de envejecimiento y degenerativos de algunos tejidos. Los diabéticos
tienen concentraciones de productos Amadori dobles y triples que los no
diabéticos. La formación de cataratas y la transformación del colágeno con la
edad pueden ser también resultado
de glicosilación no enzimático.
4. ¿Porqué
‘Homo sapiens’ es una especie longeva?
La
singularidad humana reside en el tamaño de su cerebro, en la complejidad
estructural de la corteza cerebral, y en las capacidades y comportamientos
derivados de ello: lenguaje articulado y pensamiento consciente.
Se
ha sugerido que la evolución del
cerebro requirió tanto importantes cambios anatómicos, fisiológicos y de
comportamiento, como cambios en el número y duración de las etapas de ciclo
vital. Así se prolonga el tiempo entre el destete y la maduración sexual
introduciendo una nueva etapa, la niñez (Bogin, 1999), se establece claramente
una adolescencia en ambos sexos y se prolonga considerablemente la vejez. El
prolongado período de crecimiento y desarrollo humano va ligado a bajos
requerimientos metabólicos por unidad de peso corporal (Aiello, 1995). El
cerebro es un órgano energéticamente caro, que compite con otras partes del
cuerpo en la utilización de energía nutricional. Esta competencia por recursos
nutricionales durante la etapa prenatal siempre favorece al cerebro, de tal
manera que situaciones carenciales se asocian con determinados problemas de
salud en la vejez, como la hipertensión u otros que veremos más adelante.
Durante
el desarrollo postnatal, el rápido crecimiento del cerebro entre los 0 y los 9
años, coincide con una fase latente del sistema reproductor, que no inicia su
rápido desarrollo púberal hasta que no termina el crecimiento del cerebro. Se
plantea que el elevado coste energético derivado del mantenimiento del cerebro
humano (entre un 25-40 % de la Tasa Metabólica Basal, TMB) requiere un
metabolismo más lento, al que se ajustan todos los sistemas y órganos del
cuerpo (salvo el ritmo de atresia de folículos ováricos, Bernis, 2004),
retrasando así su proceso de envejecimiento y muerte respecto a otras especies.
Las evidencias que relacionan radicales libres y
envejecimiento se basan más en correlaciones que en pruebas directas; en teoría, si el daño no reparado causado
por radicales libres es causa de envejecimiento, los animales con una alta TMB
(los que queman oxígeno con relativa rapidez), vivirían menos que los de TMB
lenta —de hecho, el metabolismo basal de una especie es inversamente
proporcional a la duración de su vida. Los tejidos del hombre producen más
superoxidodismutasa y son más resistentes a la oxidación que los de especies
menos longevas, y ello protege contra el envejecimiento; quizás en esta enzima (u otras
semejantes) esté el truco de la longevidad humana.
Resumiendo
se puede decir las características
del ciclo vital están determinadas
por la encefalización, determinan adaptaciones fundamentales como la
locomoción, la reproducción y la obtención y utilización de alimentos, y una
tasa metabólica óptima para
simultanear la formación y el mantenimiento del cerebro, y asegurar al
mismo tiempo el éxito reproductor (Aiello, 1995; Rose y Muller, 1998)
4.1. Longevidad, polimorfismos y envejecimiento
diferencial.
En el
apartado anterior se ha revisado brevemente el funcionamiento de genes
asociados con la regulación de la ontogénesis prolongada de los
humanos y su proceso de envejecimiento, que, entre otras cosas, mantienen TMB
lentas y retrasan los fallos de transcripción y de otros mecanismos reguladores
respecto a otras especies. Abordamos aquí un problema distinto, que es el de
determinar si las diferencias evidentes en edad fisiológica, en la velocidad de
envejecimiento, en la longevidad y en la presencia de determinadas
enfermedades, se puede explicar por la existencia de polimorfismos en
características bioquímicas, morfológicas y cognitivas resultantes, al menos en
parte, de la expresión de determinados genes que se expresan de manera
diferencial en las etapas finales del ciclo vital. Se han identificado algunos
genes polimórficos implicados en la regulación del envejecimiento y la muerte,
que actúan de manera independiente entre sí, algunos de los cuales son
filogenéticamente antiguos y están muy extendidos en el reino animal.
Para identificar posibles mecanismos genéticos que confieren
extraordinaria longevidad a algunos humanos frente a otros se han utilizado dos
tipos de aproximaciones:
1)
Valorar polimorfismos de algunos loci que puedan estar implicados en procesos de envejecimiento y
comparar las frecuencias alélicas de estos genes en personas muy ancianas con las de controles jóvenes, ajustando
para grupo étnico y área
geográfica.
2)
Identificar genes polimórficos implicados
en enfermedades multifactoriales de los ancianos y buscar la contribución
probable de un alelo específico en el fenotipo de la población anciana (Muiras, 2003)
Respecto al primer punto, las únicas asociaciones
confirmadas entre longevidad humana y polimorfismos se encuentra en el complejo
HLA (Ivanova et al., 1998), APOE , ACE y en la tirosina
hidrolixa (Tan et al., 2002). Respecto al segundo, se ha
sugerido que los sistemas de protección celular (el sistema inmune y los
enzimas implicados en los sistemas xenobióticos) pueden mediar en la
resistencia a enfermedades asociadas con la edad y con el propio
envejecimiento. Los enzimas implicados en el metabolismo xenobiótico son muy
polimórficos, tanto a nivel genético como funcional, y se ha encontrado que
algunos alelos aumentan el riesgo de enfermedades relacionadas con la exposición
ambiental y química (Hiroven, 1995). Algunas revisiones recientes sugieren que
la familia derivada de PARP-1 (poli ADP-ribosa- polimerasa-1) pueden tener un
papel importante en el
mantenimiento diferencial de la estabilidad del genoma, y contribuir a la
longevidad de los mamíferos, y que polimorfismos en algunos loci de control podrían generar diferencias en envejecimiento y enfermedades asociadas
(Richardson, 2003).
Altos índices de mutación están relacionados con el
envejecimiento celular, con algunas enfermedades hereditarias y con el incremento del riesgo de desarrollar
cáncer. Los mecanismos de reparación frente a mutación somática disminuyen en
la vejez y son menos eficaces en individuos con determinadas variantes alélicas
asociadas con fragilidad cromosómica, con predisposición tumoral, como la
anemia de Franconi, la ataxia talangiectasica, el Síndrome de Nijmegen y
algunos tipos hereditarios de cáncer de mama con mutaciones en los genes
BRCA1/BRCA2.
Respecto
al sistema inmune se han descrito polimorfismos para al menos seis genes de las
citokinas, aunque no hay resultados consistentes para ambos sexos sobre su
relación con longevidad. Algunas evidencias —todavía muy fraccionarias— podrían
sugerir que hombres y mujeres siguen diferentes estrategias para llegar a ser
longevos, ya que en los primeros —y no en las segundas— se encuentran
frecuencias más elevadas en los muy ancianos, respecto a los menos ancianos, de
algunos genotipos como el –1802Gc
(Muiras, 2003).
También
se han demostrado que las proteasas disminuyen con la edad en ambos sexos, y
que en los centenarios están mejor preservadas, aunque desconocemos todavía las
relaciones entre la disminución de la respuesta inmune con la edad , el cáncer,
las infecciones, el cambio en el repertorio de auto-antígenos y las bases
genéticas de la actividad inmune de las proteasas.
5. Envejecimiento y estilos de vida
Hace años que se conocen los efectos
inequívocos de factores ambiéntales sobre los procesos de envejecimiento y sus
enfermedades asociadas, especialmente los relacionados con la alimentación y la
actividad física. Están recogidos en diversos informes de la OMS (WHO, 2004) y
reflejan la culminación del enfoque ecológico de la salud iniciado por Lalonde
en 1974 y promovido por la OMS a partir de 1986 con el programa Salud para
todos en año 2000.
Este conocimiento no solo permitió establecer recomendaciones nutricionales y de estilos de vida,
sino también realizar programas de intervención para reducir mortalidad cardiovascular (OMS, 1986), con
resultados exitosos en la prevención de muerte prematura por enfermedad
cardiovascular y también de algunos tipos de cáncer (WHO, 1991; Norum, 1997;
Puska, 1997; Sulander,
2003) que permitieron,
no solo años a la vida, sino vida a los años. Además aumentan los
programas establecidos por las instituciones sanitarias que incluyen medidas
pro-activas para que los ancianos
puedan promover su propia calidad de vida (Kahana et al., 2003).
La certeza
de que el proceso de envejecimiento y muchas de las enfermedades degenerativas
y tumorales que le acompañan pueden controlarse mediante “estilos de vida
adecuados”, surge de tres fuentes
principales: a) la experimentación
animal, b) la comparación de los procesos de envejecimiento y c) de las
incidencias de enfermedad degenerativa y tumoral asociadas a la vejez en
poblaciones que desarrollan sus ciclos vitales en diferentes condiciones
ecológicas (Bernis, 2003).
5.1
Periodos sensibles, daño oxidativo
y envejecimiento.
No solamente se ha demostrado un efecto diferencial de
factores ambientales sobre el envejecimiento y las enfermedades asociadas, sino
también que los efectos son diferentes dependiendo del momento del ciclo vital
en que se produzcan. Los trabajos pioneros de Barker (1993 y 1996) y sus colaboradores ( Eriksson et al., 2001) demostraron como la
deprivación nutricional temprana tiene consecuencias para la salud en la vejez,
abriendo un nuevo campo de aproximación a la biología de la vejez —que algunos
denominan “epidemiología
auxológica”— que, basado en la perspectiva de ciclo vital, permite explicar las
diferencias en envejecimiento y enfermedad dependiendo de las condiciones
ambientales tempranas, muy especialmente de la nutrición (OMS, 2003; Cameroon y
Demetath, 2002).
La exposición a restricciones o excesos nutricionales en la
vida fetal, infancia, niñez y adolescencia puede afectar en gran mediada el
riesgo de contraer enfermedades crónicas en edades avanzadas, como
cardiovasculares y diabetes. Además, los efectos inducidos durante las etapas
tempranas del ciclo vital pueden perpetuarse a lo largo de generaciones. La
reciente revisión de Cameron y Demetath (2002) sobre la relación entre
situaciones limitantes en periodos críticos de crecimiento y la aparición de
enfermedades en la vejez, permite
concluir que los cambios en la expresión génica con la edad determinan cambios
involutivos irreversibles en las células, con manifestación morfológica y funcional. La restricción
calórica postnatal aumenta la longevidad porque retrasa la represión génica y, con ello, la
perdida de eficacia inmune, de perdida ósea y muscular, de cambios en colágeno,
en miocardio y en nefropatías, entre otros procesos. Se ha visto también como
el estrés oxidativo acelera la atrición telomérica (von Zglinicki, 2000), por
lo que la restricción calórica
retrasa el envejecimiento vía disminución de la tasa de replicación
celular (restricción del crecimiento) y, relacionado con ello, disminuyendo la
exposición a radicales libres secundarios del metabolismo de los nutrientes; por ello determinan a igual edad
cronológica telómeros mas largos y un mayor número de divisiones posibles en el
futuro.
En nuestra especie se ha demostrado que la restricción de
crecimiento in útero,
seguido de crecimiento postnatal de compensación, puede determinar
envejecimiento prematuro. La atrición de telómeros se acelera en tejido
vasculares expuestos a presión
oxidativa. De manera que la longitud del telómero podría ser un biomarcador del
envejecimiento endoltelial y del inicio de aterosclerosis. Las células blancas
de individuos con diabetes insulino-dependientes tienen telómeros reducidos
comparados con controles (Jeanclos et al., 1998).
Simplificando, podemos decir que los factores ambientales generadores de diferencias en longevidad, envejecimiento
satisfactorio y presencia de determinadas enfermedades son los que afectan de
manera diferencial a la expresión génica. La expresión génica se puede ver modificada por ajustes a la ingesta
calórica disponible durante la etapa de crecimiento y desarrollo, de manera que
grandes cantidades de energía aceleran el proceso, lo cual se traduce en
cambios fenotípicos cuantificables (menarquia más temprana, mayor tamaño, mayor IMC, etc.), mientras que
situaciones de disponibilidad energética muy justas o deficientes retrasan la
maduración y el crecimiento y determinan fenotipos de menores tamaños e IMC
(Ellison, 1990, 1996 y 2001; Lelidy, 1994). En este sentido, es interesante
recordar que algunos autores han encontrado una correlación positiva entre edad
de maduración de un órgano o sistema y el
inicio de su involución
(Wolanski, 1999). Si esto fuera así, la propia dinámica del desarrollo
ambientalmente limitada, determinaría el inicio de la involución, es decir,
generaría diferencias entre edad cronológica y edad fisiológica que se
mantendrían lo largo del ciclo vital.
Diferencias cuantitativas y cualitativas en la dieta se
asocian con producción diferencial de radicales libres que, a su vez, son
capaces de modificar la expresión génica. El mecanismo asociado a los
beneficios de la restricción calórica está relacionado con un menor consumo de
oxígeno en las mitocondrias en animales con restricción calórica y la
consecuente menor producción de radicales libres. La restricción de nutrientes
específicos que aumentan el estrés oxidativo, como las grasas y el hierro,
pueden tener efectos igualmente beneficiosos. Estos hallazgos se han confirmado
en otros mamíferos, pero no en el hombre, por razones obvias, aunque es lógico
pensar que los mecanismos sean semejantes. De hecho, la certeza de que es así
y, ante la dificultad de establecer un nivel adecuado de “restricción calórica
en humanos” (Weindruch, 1996), se
esta trabajando para desarrollar a medio plazo tecnologías que permitan simular
químicamente restricción calórica para retrasar el envejecimiento y sus
consecuencias.
Unido a dietas hipocalóricas la mejor manera de neutralizar
la acción de los radicales libres mediados por estrés oxidativo en los mayores es
la restricción de nutrientes con fuerte poder oxidativo (grasas y hierro) e
ingesta de una dieta rica en antioxidantes —que son muy abundantes en la
naturaleza— o, en su caso, incluir suplementos de antioxidanes. Son conocidos
desde hace tiempo los efectos antioxidantes del ácido ascórbico y de otras
vitaminas presentes en alimentos vegetales. Recientes revisiones aumentan la
lista de alimentos muy utilizados por algunas poblaciones y que tienen potentes
antioxidantes naturales,
como el té verde (Nakachi et al., 2003) y el ajo (Rahman, 2003).Respecto al té verde, hay
evidencias, tanto sobre animales
de experimentación como sobre humanos, de que su consumo frecuente protege
contra el desarrollo de tumores y enfermedades cardiovasculares: más de 10
tazas diarias de té verde prolonga
la vida, evitando muertes prematuras de cáncer (Nakachi et al., 2003). Respecto al consumo
continuado de ajo, Rahman (2003) afirma que puede prevenir o disminuir la
incidencia de las principales enfermedades crónicas ligadas a la edad
(arteriosclerosis, infarto, cáncer, desordenes inmunes, envejecimiento cerebral
y formación de procesos artríticos y cataratas); experimentación animal ha
demostrado que reduce además la hipercolesterolemia inducida, y estudios
epidemiológiocos en humanos sugieren una
disminución de la agregación plaquetaria y de la incidencia de cáncer (Bianchini y
Vainio, 2001) debido al potente antioxidante que posee (aliina). El ajo podría
incluso tener efectos beneficiosos
sobre el cerebro y su capacidad cognitiva, ya que a pesar de ser un sustrato
importante de oxidación y poseer un gran numero de membranas celulares ricas en
ácidos grasos polinsaturados (muy susceptibles a la peroxidación lipídica) es,
en cambio, pobre en sustancias antioxidantes.
El papel del hierro como potente oxidante capaz de acelerar
el envejecimiento general y aumentar el riesgo de hipercolesterolemia y de
enfermedades cardiovasculares ha sido discutido en diversas ocasiones,
sugiriéndose que la mayor
longevidad de las mujeres respecto a los hombres podrían relacionarse
con su menor nivel de hierro
(Polla y Polla, 2003), así como que precisamente la pérdida de la capacidad
reproductora produce un aumento de los niveles de hierro en las mujeres
postmenopasuicas que puede estar asociado con el aumento de su riesgo
cariovascular (Berge et al., 1994, Klipstein-Grobush et al., 1999; Custodio, et al., 2003).
6. Diferencias sexuales y diferencias de
género
La ontogénesis y su expresión fenotípica presentan
diferencias sexuales genéticamente reguladas y diferencias de género ligadas a
la valoración social de la mujer y a sus comportamientos diferentes de los del
hombre (Bernis, 1990).
Respecto a las diferencias sexuales, la mujer, a igual edad
cronológica, tiene desde su nacimiento una edad fisiológica más avanzada, menor
tamaño, diferente composición (más
grasa y menos músculo) y, por tanto, menores requerimientos nutricionales
excepto durante el embarazo y el período de lactancia. Las mujeres son más longevas, tienen los telómeros
más largos y, mientras mantienen su capacidad reproductora, presenta un perfil
hormonal con elevada concentración de estrógenos. Las diferencias en
envejecimiento reproductor, son especialmente llamativas, ya que, si bien el
envejecimiento en los órganos reproductores se manifiesta en ambos sexos, solo
las mujeres pierden la capacidad reproductora cuando les queda por cubrir un
tercio de su ciclo vital potencial.
La mayor longevidad de la mujer se atribuye con
frecuencia al efecto
cardio-protector de los estrógenos ováricos. Los estrógenos estimulan la
síntesis de telomerasa lo que reduce la velocidad de atrición del telómero. Se
ha sugerido que ello podría formar parte del sistema cardio-portector, al
permitir conservar más tiempo los telómeros en el sistema vascular de las
mujeres, al tiempo que permitiría comprender por qué después de la menopausia
las mujeres mantienen ventaja en longevidad, cuando pierden los estrógenos
ováricos y aumentan sus niveles de hierro.
Al comenzar este siglo, la esperanza de vida de la mujer es
mayor que la del hombre practicante en todos los países, lo que evidencia una
mejora considerable de las condiciones de vida de las mujeres, si bien esto no
ha sido siempre así ni en Europa ni en el resto del mundo en situaciones en las
que la mujer era menos valorada que el hombre y, como consecuencia, ha estado
menos protegida frente a la enfermedad y la malnutrición durante su infancia y
adolescencia (Bernis, 1987; Acsadi y Nemeskeri, 1970; UNICEF, 1985 y 2000).
Esta situación refleja que las diferencias de género se borran lentamente, pero
que la lentitud del cambio en sistemas de valores respecto a la situación de la
mujer y la fragilidad de los sistemas sanitarios en algunas poblaciones con
elevada prevalencia de SIDA podría traducirse en una inversión de la esperanza
de vida mas intensa en las mujeres.
El singular envejecimiento reproductor de las mujeres
determina peculiaridades en su proceso general de envejecimiento tras la
menopausia que deben ser tomadas en consideración. Especialmente si tenemos en
cuenta que en el mundo hay el doble de mujeres ancianas que de hombres,
conviene considerar algunas medidas específicas para que las mujeres, además de
vivir más, lo hagan en las mejores condiciones posibles. Son muy numerosos los
artículos en los que se valoran las consecuencias que la pérdida de hormonas
ováricas tienen sobre el envejecimiento general de las mujeres y su riesgo de
desarrollar enfermedades específicas como la osteoporosis y las fracturas óseas
asociadas, y en los que se recomiendan tratamiento hormonal para su prevención.
Sin embargo, resultados recientes evidencian que estos tratamientos ni son
inocuos ni son la panacea para todos los males supuestos y reales de las
mujeres postmenopaúsicas (Bernis 1987, 1991a y 1999), y que, además, son
eficaces otras medias preventivas.
Así, la promoción de otras intervenciones de control
ambiental, además de las nutricionales, deberían priorizarse en las políticas
sanitarias, especialmente algunas muy sencillas destinadas a reducir las
caídas: una actividad física para mantener el tono muscular y masa ósea, la
remodelación de aceras, utilización de bastones y de aparatos auditivos, etc.,
y la mejora de los tratamientos posteriores a las fracturas para restaurar la
función y evitar nuevas caídas (Marks et al., 2003).
Consideración final
Las diferencias en longevidad y en
las características del proceso de envejecimiento y de su asociación con
enfermedades reflejan mayoritariamente el ambiente en el que desarrollan su
ciclo vital los individuos (Mathers et al., 2002). La longevidad y la morbimortalidad específica
asociada a algunos polimorfismos
son detectables en poblaciones como las occidentales, en las que se ha controlado
la mortalidad temprana y la mayoría de las personas que nacen alcanzan edades
avanzadas. Por eso, las políticas sanitarias de modulación ambiental deben tener en cuenta que el envejecimiento
satisfactorio es un privilegio y un logro social que debe estar al alcance de
todos los ancianos y las ancianas, así como que todos los países deben
esforzase por contribuir a que las diferencias sistemáticas dentro y entre las
poblaciones en mortalidad, morbilidad y esperanza de vida sean corregidas (Tablas 2 y 3).
|
PRINCIPALES CAUSAS DE MUERTE EN EL MUNDO. (% sobre total de muertes) |
|
|
HOMBRES (2000) |
MUJERES (2000)
|
|
1-
Cardiopatía Isquémica 11,3 2-
Enfermedades
cerebrovasculares 8,2 3-
Infecciones tracto
respiratorio inferior 6,9 4-
Condiciones perinatales 4,8 5-
SIDA 4,7 6-
Enf. obstructivas crónicas pulmón 4,5 7-
Enfermedades
Diarreicas 3,6 8-
Tuberculosis 3,5 9-
Cáncer tráquea, bronquios y pulmón 3,0 10- Accidentes de tráfico 2,9 |
1-
Cardiopatía Isquémica 12,7 2-
Enfermedad
cerebrovascular 10,9 3-
Infecciones tracto respiratorio inferior 6,9 4-
Enf. obstructivas crónicas del pulmón 4,9 5-
SIDA 4,5 6-
Condiciones
perinatales 4,2 7-
Enfermedades
diarreicas 3,7 8-
Malaria 2,2 9-
Enfermedades
hipertensivas 2,1 10- Tuberculosis 2,1 |
Tabla 2. Diferencias sexuales en las 10 primeras causas de muerte en el mundo. Coinciden en 8 enferemedades como cuasas de muerte, y difieren en 2, de manera que en los hombres el cnacer de tráquea , bronquis y pulmón y los accidentes de tráfico ocupan los puestos 9 y 10, mientras que en las mujeres la malaria y las enfermedades hipertensivas ocupan los puestos 8 y 9. La malaria, y los accidentes de tráfico, contribuyen a la mortalidad en todos los grupos de edad, las otras tres contribuyen a mortalidad diferencial en edades avanzadas. Las enfermedades hipertensivas en las mujeres afectan a edades avanzadas, donde predominan las mujeres.
|
PRINCIPALES CAUSAS DE MUERTE EN EL MUNDO. (2000) (% sobre total de muertes) |
|
|
PAISES DESARROLLADOS |
PAISES EN
DESARROLLO
|
|
1-
Cardiopatía
Isquémica 23,3 2-
Enfermedades
cerebrovasculares 13,4 3-
Cáncer traquea,
bronquios pulmón 4,4 4-
Infecciones tracto
respiratorio inf. 3,6 5-
Enf. obstructivas crónicas pulmón 3,2 6-
Cáncer de colon y recto
2,3 7-
Lesiones
autoinflingidas
1,8 8-
Diabetes Mellitus
1,7 9-
Cáncer de estómago
1,7 10- Enfermedad hipertensiva 1,7 |
1-
Cardiopatía
Isquémica 9,2 2-
Enfermedades
cerebrovasculares 8,4 3-
Infecciones tracto respiratorio inf. 7,9 4-
Condiciones
perinatales 6,0 5-
SIDA
6,0 6-
Enf. obstructivas crónicas pulmón 5,2 7-
Enfermedades
diarreicas 4,6 8-
Tuberculosis 3,6 9-
Malaria
2,7 10- Accidentes de trafico 2,4 |
Tabla 3. En los países desarrollados, donde se ha completado la transición epidemiológica, 8 de las 10 principales causas de muerte son tumorales y degenerativas asociadas a la vejez, mientras que en los países en desarrollo, todavía en plena transición epidemiológica, 6 de las principales causas de muerte son infecciosas, y la cuarta afecta a condiciones perinatales.
Bibliografía
Acsádi,
G. Y Nemeskéri, J., 1970, History of Human Life Span and Mortality. Budapest: Akademia Kiado.
Aiello,
L.C., 1995, Body Size and Energy Requirements. In S. Jones & M. R. Pilbeam (eds) The Cambridge
Encyclopaedia of Human Evolution: 41-44. Cambridge University Press.
Allsopp
RC, Vaziri H, Patterson C, Goldstein S, Younglai EV, Futcher AB, Greider CW,
Harley CB, 1992, Telomere length
predicts replicative capacity of human fibroblasts. Proc. Nat, Acad Sci USA,
89: 10114-10118
Balazy, M., Nigam, S., 2003, Aging, lipid modification and phospolipasas- new concepts. Ageing Research Reviews. 2,2:191-209
Barker,
D.J.P., 1993, The foetal and infant origins of adult disease. Londres: the British Medical Journal Books
Barker,
D.J.P., 1996, Fetal growth and
long term consequences. En
Boulton J,Laron Z Rey J (eds). Long term consequences of early
feeding. Filadelfia: Lipincot-Raven:83-98et al 19
Bernis, C., 1987, “Biocultural systems and sexual
differences in longevity in the Human life cycle”. In C.Bernis & M. Sandín
(eds) Prospecting Human Ecology: 277-308. Universidad Autonoma de
Madrid.
Bernis, C., 1990, Diferencias
sexuales en los patrones de salud y enfermedad a lo largo del ciclo vital. En
Bernis, Garrido, Demonte, Calvet y Torre Rds. Los estudios sobre la mujer de la
investigación a la docencia: 15-31. Universidad Autónoma de Madrid.
Bernis,
C., 1999, “Health of women: changing lifestyles and reproductive health”. In M.
Honary & Th. Boleyn (eds) Health Ecology: 153-170 Routledge.
Bernis, C., 2001, Cambio ambiental reciente y sus consecuencias
sobre los procesos de envejecimiento reproductor en las mujeres. Revista
Española de Antropología Biológica, 22: 89-95.
Bernis, C., 2003a, Viellisement. Dans Susanne
Ch.; Rebato E.; chiarellui B (Eds) Anthropologie biologique. Evolutuion et biologie humanine:
257-539. De boek.
Bernis, C., 2004, Aspectos evolutivos y ecológicos del
envejecimiento. Encuentros multidisciplinares. 16,21:2-11
Berge, L.N., Bonaa, K.H., Nordoy, A., 1994, Serum ferritin, sex
hormones, and cardiovascular risk factors in healthy women. Arterioscler
Thromb, 14:857-861.
Bianchini,
F., Vainio, H., 2001, Allium vegetables and organosulfur compounds: do they
help prevent cancer?. Environ. Health. Perspec. 109, pp. 893–902.
Bogin, B., 1999, Patterns
of Human Growth, Cambridge University Press
Bonafe,
M., Barbi, C., Storci, G., Salvioli,
S., Capri, M., Olivieri, F., Valensin, S., Monti, D., Gonos, E.S., De Benedictis, G. and Franceschi, C. What
studies on human longevity tell us about the risk for cancer in the oldest old:
data and hypotheses on the genetics and immunology of centenarians. Exp.
Gerontol. 37 10–11
Bonner,
J.T., 1993, Life Cycles: Reflections of an Evolutionary Biologist. New Yersey:
Princeton University Press.
Cameron, N., Demetath, E., 2002, Critical
periods in human growth and their relationship to disease of aging.
Cerami, A., Vlassara, H., Brownlee,
M., Glucosa y envejecimiento . Biología del envejecimiento . Temas
Investigación y Ciencia 11:74-81.
Drew, B., Leeuwenburgh, C., 2002, Aging
and the role of reactive nitrogen species. Ann. N. Y. Acad. Sci. 959: 66-81
Custodio, E., Bernis, C., Barroso, A., Montero, P.,
Varea, C., 2003, Riesgo cardiovascular en mujeres españolas de 45-68 años: el
papel de la ferritina. Antropo, 4: 1-15. (A)
Ellison,
P.T., 1990, Human ovarian function and reproductive ecology: a new hypothesis.
Am. Anthrop. 92:933-952
Ellison,
P.T., 1996, Developmental influences on adult ovarian hormonal function.
American Journal of Human Biology, 8:725-734.
Ellison,
P.T., 2001, On Fertile Ground. A Natural History of Human Reproduction. Harvard
University Press.
Erikson,
J.G., Forsen, T., Toumulehto, J., Osdmond, C., Barker, D.J.P., 2001, Early
growth and coronary heart disease in later life: longitudinal study. Br. Med. J
(clin. Res) 310:428-432.
Hamilton, W.D., 1966, The moulding of senescence
by natural selection. Journal of Theoretical Biology, 24,395-411
Harman, D.,
1993, Free radical involvement in aging. Pathophysiology and therapeutic
implications. Drugs Aging 3
pp. 60–80
Harley, C.B., 1991, Telomerw loss: mitotic clok
or genetic time bomb?. Mutat Res, 256:271-282
Hayflick,
L., 1980, The cell biology of Human Ageing. Scientific American 242,58-65
Hirvonen,
A., 1995, Genetic factors in individual responses to environmental exposures.
J. Occup. Environ. Med. 37
: 37–43.
Ivanova,
R., Henon, N., Lepage, V.,
Charron, D., Vicaut E., Schachter,
F., 1998, HLA-DR alleles display
sex-dependent effects on survival and discriminate between individual and
familial longevity. Hum. Mol. Genet. 7, pp. 187–194
Jeanclos,
E., Krolewski, A., Skurnick, J.H.,
1998, Shortened telomere length in white blood cells of patiens with
IDDM. Diabaetes 47: 482-486
Klipstein-Grobush, K., Froster, J., Grobbe, D.E., Lindemans, U.J.,
Boeing, H., Hofman, A., Whitteman, J., 1999, Serum ferritin and risk of
myocardial infarction in the elderly: the Rotterdam study. American Journal of
Clinical Nutrition, 69:1231-1236.
Leidy, L., 1994, Biological aspects of menopause: across the
lifespan. Annu.Rev. Antrhopol,
23:231-253
Kahana, E., Kahana, B., Kercher,
K., 2003,
Emerging lifstyles and proactive options for succesful ageing. Ageing
International, 28,2:255-183
Kirkwood, T.B., 1977, Evolution of ageing. Nature (London).
Kirkwood, T., 2002, El fín del
envejecimiento. Circulo de lectores
Lucas,
A., 1994, Role of nutritional programming in determining adult morbildty Arch
Dis Chi9ild. 71:288-290
Marks,
R., Allegrante, J., Mackencie, C.R., Lane, J.M., 2003, Hip fractures among the
eldery: causes, consequences and control. Ageing Research Reviews, 2,1:57-93
Mathers,
C.D., Stein, C., Fat, D.M., Rao, C., Inoue, M., Tomijima, T., Bernard, C,.
Lopez, A.D., Murray, C.J.L., 2002, Global Burden of Disease 2000: Version 2
methods and results.
Muiras, M-L., 2003, Mammalian
longevity under the protection of PARP-1’s multifacets. Aging research reviews.
2, 2:129-148
Nakachi, K., Hidekata, E., Imai, K.,
2003, Can teatime increase one’s lifetime?. Ageing Research
Reviews. 2,1:1-10
Norum,
K.R., 1997, Some aspects of Nowegian nutrition and food poliocy en Diet,
nutrition and chronic diseases. Lessons frm a contrasting world. Shetty P &
McPherson k, eds. Wiley:195-205.
Notzon, F., Komarov, Y., Ermakov, S., Dempos,
C., Marks, J., Sempos, E., 2001, Causes of declining life expectancy in
Russia.In Davey B (Ed.) Health and Disease: A Rader. 3d Edition: Open
University Press,.
Pigliucci,
M., 2001, Phenotipic plasticity, beyond Nature and Nurture. John Hopkins
University Press.
Polla, A.S., Polla, L.L., Polla,
B.S., 2003, Iron as the malignant spirit in succesful ageing.
Ageing Research Reviews. 2,1:25-37
Puska,
P., 1997, Some aspects of Nowegian nutrition and food poliocy en Diet, nutrition
and chronic diseases. Discussion.
Lessons frm a contrasting world. Shetty P & McPherson k, eds. Wiley
:206-211
Rose, M.R., Muller,
L.D., 1998, Evolution of Human Life span: past, future and present. Am. J.Human
Biol: 409-420 .
Rahman, K., 2003, Garlic and aging: new insights into an old remedy. Ageing Research Reviews, 2,1: 57-93
Richardson,
B., 2003, Impact of aging on DNAMethylatiuon. Ageing Research Reviews.
2:245-261
Rowe,
J.W., Kahn, R.L., 1987, Human
ageing: usual and successful. Science
237,143-149.
Rusting, 1995, ¿Porqué envejecemos.
Biologia del envejecimiento. IC
Shetty,
P.D., Tedstone, A.E., 1997, The problem of obesity word-wide. Prenatal
influences on disease in later life. In Shetty PS & McPherson KM eds. Diet,
Nutrition and Chronic Diseases. Lessons from Contrasting Worlds. John Wiley
& Sons: 213-216.
Sulander, T., Helakorpi, S.,
Rahkonen, O., Nissinen, A., Uutela, A., 2003, Changes and associations in
healthy diet among the Finnish elderly, 1985-2001.: Age & Ageing,. 32, 4: 394-404
Tan,
D., Bellizzi, G., Rose, S., Garasto, C., Franceschi, T., Kruse, J., Vaupel, G.,
2000, De Benedictis and A. Yashin. The influences on human longevity by
HUMTHO1.STR polymorphism (Tyrosine hydroxylase gene). A relative risk approach.
Mech. Ageing Dev. 123:
1403-1010
UNICEF, 1985-2000 Estado mundial de
la Infgancia. Ed Crítica. Barcelona
Weindruch, R., 1996, Restri ción
calórica y envejecimiento Investigación y Ciencia ,marzo, 15-19
Williams,
G.C., 1957, Pleiotropy, natural selection and the evolution of senescence.
Evolution 11,398-411
Wolaski, N., 1999, Human Health as an Ecological Problem. En
Health Ecology. Honari E ; Boleyn T, (eds). outledge.London & NY
WHO,
1991, Study Group Report. Diet, nutrition and the prevention of chronic diseases.
Who technical report nº 797,Who, ginebra
Woods,
J.W., Weeks, S.C., Bentley, G.R.,
Weiss, K.M., 1994, Human population biology and the evolution of ageing.
En Biological Anthropology and ageing.Crews DE y Garruto RM eds.Oxford Un.
Press:19-75
von
Zglinicki, T., 2000, The role of
oxidative stress in telomere length regulation and replicative senescence. Ann NY Acad Sci, 908:99-110.
WHO
2004 http//:www. who.int/