
Paluku They They, T., Benchekroun, S., Quessar, A., 2020. Tuberculose évolutive chez les patients adultes atteints des leucémies aiguës. Antropo, 44, 49-58. www.didac.ehu.es/antropo
Tuberculose évolutive chez les patients adultes atteints des leucémies aiguës
Active tuberculosis in adults’ patients with acute leukemia
Thierry Paluku They They1,2, Said Benchekroun2, Asma Quessar2
1Unité d’Hématologie Clinique et Oncologie Pédiatrique, Hôpital 20 Août, CHU Ibn Rochd, Casablanca, Maroc.
2Institut Supérieur des Techniques Médicales (ISTM) ; Centre hospitalier de référence de Ndjili ; Kinshasa ; République Démocratique du Congo (RDC).
Auteur chargé de la correspondance: They-They Paluku Thierry. E-mail: thierrypal@yahoo.fr
Mots clés: Leucémie aiguë, tuberculose, Maroc.
Keywords: Acute Leukemia, Tuberculosis, Morocco.
Résumé
Chez les patients atteints de leucémie aigüe (LA), en tant qu'état d’immunodépression, la tuberculose est rarement rapportée et reste un problème majeur.
Dans une étude rétrospective, nous évaluons la fréquence de la tuberculeuse et l'impact du traitement antituberculeux (TAT) dans la prise en charge de LA chez les patients dont les dossiers médicaux ont été analysés.
Sur un total de 1 360 cas colligés, 886 LAM (myéloïde) et 474 LAL (lymphoïde), seul 9 cas de tuberculose sont confirmés avec une fréquence estimée de 0,79 % pour la LAM et 0,42 % pour la LAL. L'âge médian était de 30 ans (19 à 42 ans). Le sex ratio H/F de 1,25. Le délai médian entre le diagnostic de leucémie et de tuberculose était de 6 mois (intervalle 1 à 24 mois). Ce diagnostic intervient soit avant la leucémie, soit en post-induction, ou en traitement d’entretien ou simultané avec la LA et en post-mortem. Les tuberculoses pulmonaires et extrapulmonaires (splénique, ganglionnaires et cutanée) sont observées. Une bonne réponse au TAT est observée à 89 % (8 cas/9 cas). La rémission complète de la LA est obtenue à 55,5 %. Deux patients décédés n'ont reçu aucun TAT. Un patient a été inclus en soins palliatifs et perdu de vue au cours du suivi.
Un faible taux de tuberculose est observé dans notre étude. Le traitement antituberculeux n'entraine pas de retard de chimiothérapie ni d'aggravation de la leucémie dans les cycles suivants. Ainsi, une fièvre prolongée chez les patients immunodéprimés, en particulier dans le contexte d'une zone d'endémie, la tuberculose doit être évoquée parmi d'autres hypothèses diagnostiques.
Abstract
In acute leukemia patients, as immunocompromised condition, tuberculosis (TB) is rarely reported, and remains a major problem.
In a retrospective study, we assess TB infection frequency and antituberculous treatment (ATT) impact in management of acute leukemia’s patients then their medical records were reviewed.
A total of 1,360 cases included in our study, 886 acute myeloid leukemia (AML) and 474 acute lymphoid leukemia (ALL), only nine patients were TB confirmed diagnosis with frequency of TB at 0.79 % for AML and 0.42 % for ALL. The median age was 30 years (ranging 19 to 42 years), with a male: female ratio of 1.25.
The median time from diagnosis of leukemia and tuberculosis was 6 months (range 1 - 24 months). TB occurred before leukemia diagnosis or in period following post-induction phase, or simultaneously with Leukemia. TB diagnosis was made in consolidation and maintenance therapy, and post-mortem in one case. The involved organs were pulmonary and extrapulmonary TB (lymph node, spleen and skin). Good response to ATT was noted in 89 % (8 case versus 9 cases) with resolution of TB related symptoms. The complete remission was achieved in 55.5 % of leukemia’s patients. Two patients died, and did not receive any TB treatment. One patient was included in palliative care and lost in follow up.
We found a low rate of TB disease in our studies’ population. Overall, TB treatment did not cause delay chemotherapy or worsening of leukemia in subsequent cycles. Thus, prolonged fever in immunocompromised patients, particularly in the context of endemic area, TB should be suggested among other diagnostic hypotheses.
Introduction
La principale cause de mortalité et de morbidité chez les patients atteints de leucémie aiguë est leur prédisposition aux infections (Jagarlamudi et al.,2000 ; Gupta et al.,2009). Le facteur de risque le plus important à ces infections est la neutropénie (Crawford et al., 2004).
Pendant la période neutropénique, le patient est sujet à développer principalement les infections bactériennes et fongiques, et plus rarement des mycobactéries peuvent également être impliquées (Kamboj et Sepkowitz, 2006).
Les infections tuberculeuses n’ont pas été couramment rapportées dans la plupart des séries (Mishra et al., 2006 ; Lesaca-Medina et Maramba-Lazarte, 2009). La tuberculose maladie est liée à une diminution de l'immunocompétence, or les patients atteints de la leucémie aiguë ont une immunocompétence réduite par une myélosuppression significative en raison soit de leur maladie et/ou des effets secondaires du traitement. En effet, il a été rapporté qu'une chimiothérapie cytotoxique et une corticothérapie à forte dose peuvent induire une réactivation de la tuberculose latente (Sahn et Lakshminarayan, 1976 ; Misonou et al., 1987).
Dans un pays à forte prévalence de la tuberculose comme le Maroc, la plupart des gens ont des lésions tuberculeuses inactives et une positivité au test tuberculinique. De plus, la culture mycobactérienne peut prendre plusieurs semaines, retardant souvent le diagnostic et le début du traitement. Ce retard diagnostique, et ses conséquences indésirables, sont encore plus importants chez les patients immunodéprimés chez lesquels le tableau clinique est souvent non spécifique et la progression de la tuberculose est plus rapide (Jereb et al, 2011). Par conséquent, un indice élevé de suspicion clinique est important pour un diagnostic et une prise en charge précoce en vue d’une amélioration clinique des patients.
Nous présentons une étude rétrospective de la tuberculose chez les patients atteints de la leucémie aigüe admis pour traitement en unité d'hématologie et d'oncologie pédiatrique, en vue d’évaluer sa fréquence, ses complications et sa réponse au traitement dans la prise en charge des patients atteints de leucémie aiguë.
Patients et méthodes
Entre mai 2003 et octobre 2013, tous les patients traités pour une leucémie aiguë diagnostiquée sur la base clinique et de l'examen du frottis sanguin médullaire, et du sang veineux ou périphérique, à l'hôpital 20 août d'hématologie et d'oncologie pédiatrique du Centre Hospitalier Universitaire Ibn Rochd de Casablanca et qui ont développé la tuberculose diagnostiquée sur la base clinique, radiographique pulmonaire, de l'examen des expectorations et confirmée microbiologiquement et/ou histologiquement ont été inclus dans notre étude.
Tout patient avec suspicion de tuberculose en l'absence de preuve bactériologique ou histologique, ou les patients ayant une bonne réponse au traitement d’épreuve antituberculeux initié sans confirmation diagnostique de tuberculose ont été exclus.
Les dossiers médicaux, les données microbiologiques, histologiques et radiologiques des patients atteints de leucémie aiguë qui ont développé une tuberculose ont été examinés. Pour tous les patients, les informations démographiques et celles spécifiques à la leucémie, à savoir le type de leucémie, les phases de traitement et la durée de la maladie au moment du diagnostic de la tuberculose ; ainsi que les informations spécifiques à la tuberculose, notamment le site de l’infection, la réponse au traitement et les résultats obtenus, ont été examinés à partir des dossiers des patients.
Les schémas thérapeutiques étaient l’association des plusieurs agents antituberculeux dont la première phase d’attaque de 2 mois comprenant l’association de RHZE, suivie d’une phase d’entretien de 4 mois associant 2 médicaments RH à la dose de l'isoniazide (H) 5 mg/kg/j, la rifampicine (R) 10 mg/kg/j, l'éthambutol (E) 15 mg/kg/j et le pyrazinamide (Z) 25 mg/kg/j sous forme combinée.
Résultats
Pendant une période d'étude de 10 ans, un total de 1 360 cas de leucémie dont 886 cas de leucémie myéloïde aiguë (LAM) et 474 cas de leucémie lymphoïde aiguë (LAL) ont été admis dans notre unité de soin. La confirmation diagnostique de tuberculose a été notée chez 9 patients dont 7 cas de LAM et 2 cas de LAL. Ceci correspondant à une fréquence de tuberculose de 0,79 % pour la LAM et de 0,42 % pour la LAL. L'âge moyen est de 30 ans (avec des extrêmes allant de 19 à 42 ans). Cinq cas étaient de sexe masculin et quatre cas de sexe féminin avec un sex ratio homme: femme de 1,25.
Pour trois patients, la tuberculose est survenue au cours de la période d'aplasie suivant la première phase d'induction. Malgré l'amélioration du nombre de neutrophiles, la fièvre a été persistante chez tous les patients. La forme de tuberculose pulmonaire a été notée chez 2 patients et une lymphadénopathie tuberculeuse médiastinale chez un patient avec une coloration de Ziehl-Nelseen (ZN) des expectorations et/ou un liquide de lavage broncho-alvéolaire positif aux bacilles alcoolo-acido-résistants (BAAR) à l’examen microscopique direct.
Chez un patient atteint de leucémie aiguë promyélocytaire ou LAM3 selon la classification Franco-americano-britannique (FAB), le diagnostic de TB a été confirmé par une coloration au ZN des expectorations et une culture positive sur milieu de Loweinstein-Jensen (LWJ).
Tous les patients ont obtenu une rémission complète (RC) après le traitement d'induction et ont montré une amélioration de leurs symptômes liés à la tuberculose, sont devenus afébriles sous traitement antibuberculeux. Malheureusement, une patiente a développé un cancer du sein sept ans plus tard. Elle est toujours en RC pour sa leucémie et sous traitement contre son cancer du sein.
Un patient avec une leucémie aigue myélomonocytaire ou LAM4 selon la classification FAB, a développé une aspergillose invasive dans les suites de la première chimiothérapie d'induction confirmée par une opacité excavée montrée au scanner thoracique (Figure 1).
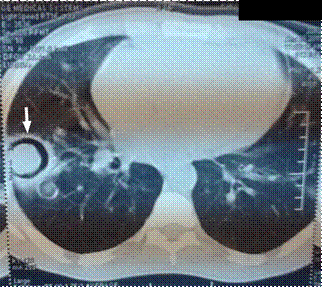
Figure 1. Scanner thoracique Cas N°1 montrant une image d’opacité excavée du poumon droit (flèche blanche)
Figure 1. Chest CT scan of Case N°1 showed excaved opacity image in right chest (white arrow).
La bronchoscopie avec lavage broncho-alvéolaire (LBA) a conclu à une inflammation diffuse sans BAAR à la coloration ZN. Son amélioration clinique et ses lésions thoraciques ont disparu après 6 semaines de traitement antifongique à base du Voriconazole IV à la dose de 6 mg/Kg, deux fois au premier jour puis 3 mg/Kg, deux fois par jours suivant puis 200 mgx2/j per os. Le patient a développé du délire, des hallucinations et de la confusion comme effets secondaires du traitement fongique. La tuberculose a été diagnostiquée après la rémission complète de sa Leucémie par une biopsie de la rate (Figure 2).
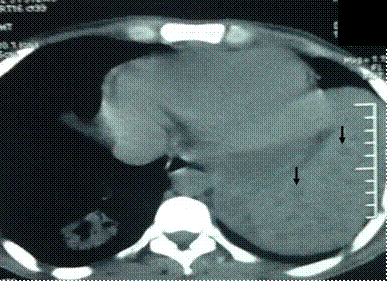
Figure 2. Scanner abdominal du Cas n°1 montrant des images micronodullaires spléniques diffuses infiltrées par des petites lésions hypodenses compatibles avec des granulomes spléniques (flèches noires).
Figure 2. CT scan of the abdomen of the Case 1 showing a micronodular spleen diffusely infiltrated by small, hypodense lesions consistent with splenic granulomas (black arrows).
Il a reçu une deuxième chimiothérapie d'induction suivie d'antituberculeux. Le patient a montré une amélioration clinique avec résolution des lésions tuberculeuses de la rate.
Le patient a reçu deux autres phases de chimiothérapie de consolidation avec une cytosine arabinoside modifiée à haute dose, en raison d'antécédents de toxicité médicamenteuse, mais a rechuté de sa leucémie après dix-sept mois de suivi. Il est décédé des suites d'une complication liée à sa leucémie.
Un autre patient avait des antécédents de tuberculose il y a quinze ans, et une tuberculose miliaire active a été diagnostiquée un mois avant le diagnostic de LAM. Il a reçu des antituberculeux en association de sa chimiothérapie complète contre la leucémie aiguë. Il a montré une résolution des lésions thoraciques et a obtenu une RC pour sa LAM. Le patient est en vie et en RC soutenue.
Pour trois patients, le diagnostic de la tuberculose a été posé simultanément avec ceux de la LAL et la LAM respectivement pour 1 et 2 patients. Une patiente atteinte de LAL et de tuberculose pulmonaire a commencé la phase d’attaque antituberculeuse en association avec les corticostéroïdes du protocole de chimiothérapie de la LAL. Elle n'a pas répondu au traitement par corticostéroïdes et n'a pas réussi à obtenir une RC après l'induction. Elle a montré une bonne réponse aux antituberculeux définie par l’absence de BAAR lors de l'examen des expectorations après 2 mois de traitement antituberculeux. La patiente a développé une thrombose veineuse profonde iliaque droite de la jambe compliquée d'une embolie pulmonaire.
En raison d'une mauvaise réponse au traitement de la LAL, définie par l’absence d’amélioration clinique et de l'état général après le traitement d'induction, la patiente a été incluse aux soins palliatifs.
Pour un autre patient atteint de LAM, le diagnostic de la tuberculose a été confirmé post-mortem par l’examen du pus de l'abcès cervical qui avait montré la présence des BAAR à l’examen après coloration au ZN. Il n'a reçu aucun traitement antituberculeux, et est décédé lors d'un traitement de chimiothérapie d'induction.
Chez un patient, une tuberculose cutanée a été diagnostiquée avec une LAM. Elle a commencé le traitement antituberculeux avec une amélioration des lésions cutanées axillaires. En raison du statut cytogénétique complexe de sa LAM, très souvent associé à un pronostic péjoratif, la patiente a été incluse aux soins palliatifs. Elle était perdue dans le suivi.
Le dernier patient a développé une tuberculose ganglionnaire au septième mois de traitement d'entretien de la LAL consistant en une administration mensuelle de mercaptopurine, dexaméthasone, de méthotrexate et de vincristine. L'aspiration de la moelle osseuse était normale. Le patient a reçu un traitement antituberculeux suivi d’une résolution complète de sa lymphadénopathie considérée comme une amélioration clinique de sa tuberculose. Les résultats sont résumés dans les tableaux 1 et 2.
|
Paramètres |
Cas n°1 |
Cas n°2 |
Cas n°3 |
Cas n°4 |
|
Age (ans) |
31 |
24 |
40 |
42 |
|
Sexe |
M |
M |
M |
F |
|
Type de LA (FAB) |
LAM4 |
LAM0 |
LAM0 |
LAM2 |
|
Caryotype |
inv16 |
complexe |
Trisomie 8 ; trisomie 22 |
échec |
|
Délai diagnostic entre LA et TBC (mois) |
5 |
3 |
5 |
2 |
|
Présentation clinique |
A J27 de la 1ère Induction de la LA, opacité excavée (aspergillose invasive) avec RC post induction. Avant la seconde induction : micronodules spléniques |
Au diagnostic de LA : Lymphadénopathie cervicale bulky, rétention urinaire, et paraparésie |
A J21 de l'induction ; fièvre, sueurs nocturnes, et amaigrissement |
A J44 de l’induction : fièvre, nodules spléniques |
|
Sites des lésions tuberculeuses |
Rate |
Ganglion |
Poumon |
Ganglion médiastinal |
|
Méthodes diagnostiques |
Biopsie splénique: granulomes avec nécrose caséeuse compatible avec une tuberculose splénique. |
Coloration Ziehl-Neelsen (ZN) du pus ganglionnaire : BAAR + |
-Scanner thoracique: multiples nodules necrosés peri-hilaires pulmonaires. -Traitement d’épreuve antituberculeux : bonne réponse |
- Scanner thoracique: multiples ganglions médiastinaux peri-hilaires nécrosés - Coloration ZN LBA : BAAR + - Bronchoscopie: ganglion médiastino-bronchial fistulisé. - Test IDR de Mantoux : positive à 20 mm de diamètre d’induration. |
|
Délai de la réponse au traitement Antituberculeux TAT (mois) |
6 |
Aucun, diagnostic fait en post-mortem |
6 |
Oui , 8 mois |
|
Réponse à la CTH antileucémique |
Rechute de LAM, 17 mois après RC puis inclue en soins palliatifs jusqu’au décès. |
Décès au décours de la CTH de LAM |
CTH anti LAM (cycle complet) et TAT, avec RC. Patient en RC soutenue. |
CTH anti LAM (cycle complet) et TAT, avec RC. Patient en RC soutenue. 7 ans après, cancer du sein. En vie sous traitement anticancéreux mammaire. |
Tableau 1. Caractéristiques cliniques des quatre patients leucémiques avec tuberculose.
Table 1. Clinics characteristics of four leukemia’s patients with tuberculosis.
M, masculin ; F, féminin ; LAM, leucémie aigue myeloide; LAL, leucémie aigue lymphoide ; ATCD, antécédent ;LBA : liquide broncho-alvéolaire ; TAT, traitement antituberculeux ; RC, rémission complète; ZN, Ziehl-Nelseen; IDR, Intradermoréaction; BAAR, bacilles alcoolo-acido-résistants; CTH : chimiothérapie ;
* : (44 ,XX,der2, der7 (del7q ?),der 8(del8q22 ?),der11(add11) ,der18(del8q?) ,-1,-11,-17, +mar1 ,+mar2, +mar3 ,+mar4 [8/20] /45,XX,der2,der7(del7q?),der8(del8q22?),der11(add11),der18(del18q?),-1,-11,-17,+mar1,+mar2,+mar3[6/20]/46,XX, der2 ,der7(del7q?) ,der8(del8q22?),der11(add11),der18(del18q?),-1,-11,-17, +mar1 ,+mar2+[4/20]/46,XX[2/20]
|
Paramètres |
Cas n°5 |
Cas n°6 |
Case n°7 |
Cas n°8 |
Cas n°9 |
|
Age (ans) |
25 |
28 |
25 |
36 |
19 |
|
Sexe |
F |
M |
F |
F |
M |
|
Type de LA (FAB) |
LAM3 |
LAM2 |
LAM2 |
LAL1/LAL T |
LAL2 |
|
Caryotype |
t(15 ;17) |
t(8 ;21) ;del9 |
Complexe* |
del5q |
normal |
|
Délai diagnostic entre LA et TBC (mois) |
1 |
0 |
0 |
2 |
24 |
|
Présentation clinique |
A J30 de la 1ère induction: fièvre, syndrome de détresse respiratoire aigüe (SDRA) |
ATCD de tuberculose 15 ans auparavant. 1 mois avant le diagnostic de LAM: fièvre, toux, amaigrissement, sueurs nocturnes, hémoptysies… |
Au diagnostic de la LAM: fièvre, lymphadénopathie axillaire droite fistulisée |
Au diagnostic de la LAL: fièvre, toux, multiple lymphadénopathie, embolie pulmonaire, thrombose veineuse iliaque de la jambe droite |
Pendant le traitement d’entretien: fièvre, fistule des ganglions lymphatiques |
|
Sites des lésions tuberculeuses |
Poumon |
Poumon |
Peau |
Poumon |
Ganglion |
|
Méthodes diagnostiques |
- Radiographie et scanner thoracique: Multiples opacités apicales droites. – Coloration ZN expectoration : BAAR +, - Culture sur milieux Loweinstein-Jensen (LJ) des crachats : BAAR+. |
Radiographie thoracique : images d’opacités miliaires concluant à une tuberculose milliaire. |
Biopsie cutanée: surface ulcérée ; processus inflammatoire infiltrant les vaisseaux dermiques; granulome epithelioide à cellules géantes tuberculoides contenant une nécrose caséeuse centrale; faible BAAR |
- Radiographie et scanner thoracique : multiple nodules pulmonaires bilateraux, épanchement pleural gauche avec élargissement médiatinal. – Coloration ZN expectoration : BAAR +. |
Biopsie ganglionnaire: granulomes à cellules epithelioides avec une nécrose caséeuse centrale ; granulomatoses, avec cellules epithelioides macrophagiques et celules géantes de Langhans. |
|
Délai de la réponse au TAT (mois) |
Après 6 |
8 |
6 |
6 |
5 |
|
Réponse à la CTH antileucémique |
CTH anti LAM (cycle complet) et TAT, RC et BAAR négatif à 2 mois de traitement. CTH de consolidation et entretien. En vie en RC+entretien. |
CTH anti LAM (cycle complet) et TAT, avec RP (1ère induction) et RC (2ème induction) et amélioration radiologiques pulmonaires. En vie et en RC soutenue. |
Soin palliatif pour sa LAM mais bonne réponse au TAT par une amélioration clinique des lésions cutanées. Patiente PDV dans les suites thérapeutiques. |
Bonne réponse TAT: BAAR-. Aucune réponse à la corticothérapie antiléucémique et échec thérapeutique par absence de RC à CTH. Soin palliatif. |
Bonne réponse aux TAT. Patient est en rémission et à la fin de son traitement d’entretien. |
Tableau 2. Caractéristiques cliniques des cinq patients leucémiques avec tuberculose.
Table 2. Clinics characteristics of five leukemia’s patients with tuberculosis.
M, masculin ; F, féminin ; LA : leucémie aiguë ; LAM, leucémie aigue myeloide; LAL, leucémie aigue lymphoide ; ATCD, antécédent ;LBA : liquide broncho-alvéolaire ; TAT, traitement antituberculeux ; RC, rémission complète; RP : rémission partielle ; ZN, Ziehl-Nelseen; BAAR, bacilles alcoolo-acido-résistants; ARDS, acute respiratory distress syndrome ; PDV, perdu de vue ; CTH : chimiothérapie ;
* : (44 ,XX,der2, der7 (del7q ?),der 8(del8q22 ?),der11(add11) ,der18(del8q?) ,-1,-11,-17, +mar1 ,+mar2, +mar3 ,+mar4 [8/20] /45,XX,der2,der7(del7q?),der8(del8q22?),der11(add11),der18(del18q?),-1,-11,-17,+mar1,+mar2,+mar3[6/20]/46,XX, der2 ,der7(del7q?) ,der8(del8q22?),der11(add11),der18(del18q?),-1,-11,-17, +mar1 ,+mar2+[4/20]/46,XX[2/20]
Discussion
Les complications infectieuses sont courantes chez les patients leucémiques. Les études antérieures ont rapporté une fréquence plus élevées des infections bactériennes et fongiques comparées aux infections à mycobactéries (Kumar et al.,1992 ; Gupta et al.,2010). La fréquence de la tuberculose dans notre étude était de 0,42 % et 0,79 % respectivement pour la LAL et la LMA. Nos résultats sont comparables avec ceux rapportés antérieurement chez les patients atteints de leucémie aiguë occidentale, qui ont montré une faible prévalence de la tuberculose estimée entre 0,3 à 0,4 % des cas (Kaplan et al., 1974 ; Feld et al., 1976), ou proche de 0 % rapporté chez les patients LAL saoudiens (Al-Anazi et al., 2007), et un taux élevé de tuberculose infection mais un faible taux de tuberculose maladie chez les patients philippins atteints de leucémie aiguë (Lesaca-Medina et Maramba-Lazarte, 2009).
Comparés aux résultats rapportés dans plusieurs pays en développement, nos résultats sont de loin inférieurs à ceux de la fréquence de la tuberculose dans la leucémie aiguë en inde variant de 2,7 (Srivastava et al. 1996) à 6,7 % (Mishra et al. 2006) et à 3,1 % chez les patients saoudiens atteints de LAM (Al-Anazi et al. 2007).
L'incidence de la tuberculose (pour 100 000 habitants) au Maroc a été rapportée pour la dernière fois en 2011 à 103 cas, selon un rapport de la Banque mondiale publié en 2013 (OMS, 2013). Sa prévalence tend à s’étendre lentement avec 2 à 3 % de cas notifiés par an grâce aux efforts du gouvernement marocain pour lutter contre la tuberculose. Cela pourrait expliquer en partie la faible fréquence dans notre population d'étude. La détection plus élevée de l'infection à M. tuberculosis reflète une tendance à l'augmentation de la prévalence de l'infection dans la population générale.
Dans notre étude, la tuberculose était préférentiellement pulmonaire chez 4 patients avec une forme miliaire chez un patient et 5 cas de tuberculose extrapulmonaire dont un cas pour chacun des organes suivants: les ganglions lymphatiques périphériques et médiastinaux, la rate et la peau. En effet, L'atteinte extrapulmonaire est plus fréquente chez les patients immunodéprimés (Skogberg et al. 1993) notamment ceux atteints de leucémie aiguë (Mishra et al., 2006).
Une étude antérieure a rapporté, une fréquence élevée de la tuberculose dans la LAM que dans la LAL comme dans notre étude (Mishra et al. 2006). La raison de cette prépondérance LAM n'est pas élucidée clairement. Le dysfonctionnement des monocytes/macrophages a été suggéré (Mishra et al. 2006). Le traitement avec des stéroïdes et d'autres thérapies immunosuppressives, comme le méthotrexate, qui entraîne une immunité à médiation cellulaire défectueuse, utilisé dans le traitement de la LAL pourrait être le principal facteur d'infection tuberculeuse. Des lors, on s'attendrait donc à une augmentation de la prévalence de la tuberculose dans la LAL que dans la LAM.
Selon une autre étude (Skogberg et al., 1993), les symptômes de la tuberculose peuvent mimer ceux d’une maladie sous-jacente, conduisant ainsi à un retard du diagnostic correct et à une augmentation du traitement immunosuppresseur. Pour cette raison, la tuberculose chez les patients immunodéprimés est dans la plupart du temps déjà à un stade avancé avant d'être reconnue par le médecin (Furst et al., 2002). C'était le cas d’un patient atteint de LAM décédé sans avoir reçu un traitement antituberculeux à cause du diagnostic tardif dans notre étude. Cela soulève la place du traitement antituberculeux d’épreuve ou empirique dans notre contexte tel que suggeré par Anglaret et al. (1994) qui ont montré l'efficacité du traitement antibuberculeux empirique (TATE) commencé avant la confirmation diagnostic de la tuberculose. En effet, La rifampicine, étant un antibiotique à large spectre, pourrait être efficace dans les infections autres que la tuberculose (Anglaret et al., 1994).
Comme rapporté chez un patient avec atteinte splénique dans notre étude, la tuberculose dans les zones endémiques est considérée comme une cause possible d'abcès hépatospléniques pendant les périodes prolongées de neutropénie post chimiothérapie cytotoxique administrés aux patients atteints de leucémie aiguë (Lee et al., 2001).
Une fois le traitement antituberculeux commencé, une bonne réponse peut être obtenue chez 90 % des patients, bien qu'une issue fatale ait été rapportée chez des patients atteints de tuberculose miliaire (Adzic, 2004). Tous nos 8 patients atteints de leucémie aiguë qui ont reçu un traitement antituberculeux ont montré une bonne réponse au traitement antituberculeux. La tuberculose détectée tôt répond facilement au traitement avec des médicaments appropriés et ne semble pas avoir une influence négative sur la prise en charge de la leucémie aiguë (Mishra et al. 2006).
Dans notre étude, cinq patients étaient en rémission complète estimé à 56 %, après les traitements antituberculeux et anti-leucémiques. Deux patients sont décédés, un après la rechute de sa leucémie, et un autre avant la confirmation du diagnostic de tuberculose, n’ayant bénéficié d’aucun traitement antituberculeux. Un patient était en soins palliatifs après échec du traitement contre la leucémie, mais avec un succès thérapeutique aux antituberculeux.
En conclusion, dans les pays en développement où la tuberculose est endémique, sa fréquence chez les patients leucémiques peut être encore plus élevée. Dans notre étude, nous avons trouvé une très faible association. En raison de la bonne réponse aux traitements antituberculeux, en cas de forte suspicion de tuberculose, un diagnostic précoce est nécessaire dans la leucémie aiguë. Nous suggérons un traitement antituberculeux empirique qui semble être une méthode utile pour un rapide diagnostic de présomption et le traitement de la tuberculose.
Références bibliographiques
Adzic, T., 2004, Pulmonary tuberculosis in patients with hematological malignancies. Med Pregl. 57: 65-68.
Al-Anazi, K. A., Al-Jasser, A. M., Evans, D. A. P. 2007. Infections caused by mycobacterium tuberculosis in patients with hematological disorders and in recipients of hematopoietic stem cell transplant, a twelve year retrospective study. Annals of Clinical Microbiology and Antimicrobials, 6(1), 1-7.
Anglaret, X., Saba, J., Perronne, C., Lacassin, F., Longuet, P., Leport, C., Vilde, J. L. 1994. Empiric antituberculosis treatment: benefits for earlier diagnosis and treatment of tuberculosis. Tubercle and Lung Disease, 75(5), 334-340.
Jereb, J. A., Goldberg, S. V., Powell, K., Villarino, M. E., Lobue, P. 2011. Recommendations for use of an isoniazid-rifapentine regimen with direct observation to treat latent Mycobacterium tuberculosis infection. MMWR. 60 (48): 1650- 1653.
Crawford, J., Dale, D. C., Lyman, G. H. 2004. Chemotherapy‐induced neutropenia: risks, consequences, and new directions for its management. Cancer, 100(2), 228-237.
Feld, R., Bodey, G. P., Gröschel, D. 1976. Mycobacteriosis in patients with malignant disease. Archives of Internal Medicine, 136(1), 67-70.
Furst, D. E., Cush, J., Kaufmann, S., Siegel, J., Kurth, R. 2002. Preliminary guidelines for diagnosing and treating tuberculosis in patients with rheumatoid arthritis in immunosuppressive trials or being treated with biological agents. Annals of the Rheumatic Diseases, 61(suppl 2), ii62-ii63.
Gupta, A., Singh, M., Singh, H., et al. 2010. Infections in acute myeloid leukemia: an analysis of 382 febrile episodes. Medical Oncology, 27(4), 1037-1045.
Jagarlamudi R., Kumar L., Kochupillai V., Kapil A., Banerjee U. and Thulkar S. , 2000, Infections in acute leukemia: an analysis of 240 febrile episodes. Medical Oncology. 17, 111-116.
Kamboj, M., Sepkowitz, K. A. 2006. The risk of tuberculosis in patients with cancer. Clinical Infectious Diseases, 42(11), 1592-1595.
Kaplan, M. H., Armstrong, D., Rosen, P. 1974. Tuberculosis complicating neoplastic disease. A review of 201 cases. Cancer, 33(3), 850-858.
Kumar, L., Kochupillai, V., Bhujwala, R. A. 1992. Infections in acute myeloid leukemia. Study of 184 febrile episodes. The Journal of the Association of Physicians of India, 40(1), 18-20.
Lee, D. G., Choi, J. H., Kim, Y. J., et al. 2001. Hepatosplenic tuberculosis mimicking disseminated candidiasis in patients with acute leukemia. International Journal of Hematology, 73(1), 119-121.
Lesaca-Medina, M. Y. A., Maramba-Lazarte, C. 2009. The Prevalence of TB infection and disease among children with acute leukemia. PIDSP Journal, 10(1), 13-20.
Mishra, P., Kumar, R., Mahapatra, M., et al. 2006. Tuberculosis in acute leukemia: A clinico-hematological profile. Hematology, 11(5-6), 335-340.
Misonou, J., Kikuchi, Y., Aizawa, M., et al. 1987. An autopsy case of severe miliary tuberculosis in a patient with acute lymphatic leukemia (ALL). Gan No Rinsho. Japan journal of cancer clinics, 33(6), 703-713.
OMS, 2013. Rapport 2013 sur la lutte contre la tuberculose dans le monde. https://www.who.int/tb/publications/global_report/grtb13_executive_summary_fr.pdf
Sahn, S. A., Lakshminarayan, S. 1976. Tuberculosis after corticosteroid therapy. British Journal of Diseases of the Chest, 70, 195-205.
Skogberg, K., Ruutu, P., Tukiainen, P., Valtonen, V. 1993. Effect of immunosuppressive therapy on the clinical presentation and outcome of tuberculosis. Clinical Infectious Diseases, 17(6), 1012-1017.
Srivastava, V. M., Krishnaswami, H., Srivastava, A., Dennison, D., Chandy, M. 1996. Infections in haematological malignancies: an autopsy study of 72 cases. Transactions of the Royal Society of Tropical Medicine and Hygiene, 90(4), 406-408.