
Lghoul, S., Loukid, M., Hilali, M.K., 2020. Age à la ménarche, facteurs anthropométriques et saisonniers : une étude auprès des adolescentes scolarisées (Wilaya de Marrakech). Antropo, 44, 31-40. www.didac.ehu.es/antropo
Age à la ménarche, facteurs anthropométriques et saisonniers : une étude auprès des adolescentes scolarisées (Wilaya de Marrakech)
Age at menarche, anthropometric and seasonal factors: a study among adolescent’s schoolgirls (Wilaya of Marrakech)
Siham Lghoul, Mohamed Loukid, Mohamed Kamal Hilali
Laboratoire de l’Ecologie Humaine. Département de Biologie. Faculté des Sciences Semlalia. Université Cadi Ayyad. Marrakech.
Correspondance: Siham Lghoul. Email: siham.lghoul@gmail.com
Mots-clés : Age à la ménarche, Anthropométrie, Saisons, Adolescentes, Santé, Marrakech.
Keywords: Age at menarche, Anthropometric, Seasons, Adolescent’s girls, Health, Marrakesh.
Résumé
Objectif : L’âge à la ménarche est le marqueur le plus utilisé pour qualifier la santé reproductive chez les jeunes filles. Le but de l’étude est la détermination de l’âge à la ménarche et ses déviations par rapport à la normal en relation avec les facteurs anthropométriques et saisonniers.
Echantillon : Il s’agit d’une enquête transversale qui a ciblé 524 filles scolarisées et qui a été réalisés entre 2017-2018 dans des établissements scolaires de la Wilaya de Marrakech. Un questionnaire anonyme a constitué le matériel de base pour la collecte des données. Les résultats obtenus ont été analysés par le logiciel SPSS.22.
Résultats : L’âge à la ménarche moyen et médian trouvés dans le cadre de notre étude sont successivement de 12,87±1,30 ans et 13,00±1,30 ans. La prévalence de la ménarche précoce est de 14,90 % et celle de la ménarche retardée est de 9,50 %. Dans le cadre de notre étude, nous avons trouvé que l’âge à la ménarche est inversement lié à l’IMC mais il n’est pas lié à la taille ni au poids. Les participantes ayant eu une ménarche précoce ont une taille plus faible par rapport à celles qui ont eu leurs premières règles tardivement. La ménarche survient plus fréquemment en hiver (49 %) et la plupart des participantes ayant une ménarche tardive (70 %), ont déclaré l’avoir eu en hiver.
Conclusion : L’âge à la ménarche est lié à l’IMC mais il n’est pas influencé par le facteur saisonnier.
Abstract
Objective: Age at menarche is the most widely used marker for reproductive health in young girls. The aim of the study is to determine age at menarche and its deviations from normal in relation to anthropometric and seasonal factors.
Sample: This was a cross-sectional survey that targeted 524 schoolgirls and was conducted between 2017-2018 in schools in the Wilaya of Marrakech. An anonymous questionnaire constituted the basic material for data collection. The results obtained were analyzed using SPSS.22 software.
Results: The mean and median age at menarche found in our study were successively 12.87±1.30 years and 13.00±1.30 years. The prevalence of early menarche is 14.90 % and that of late menarche was 9.50 %. In our study, we found that age at menarche is inversely related to BMI but it is not related to height or weight. Participants with early menarche have a lower height compared to those who had their first period late. Menarche occurs more frequently in the winter (49 %) and most participants with late menarche (70 %) reported having it in the winter.
Conclusion: Age at menarche is related to BMI but is not influenced by seasonality.
Introduction
La ménarche survient vers la phase finale de la maturation sexuelle, généralement après le début du développement des seins et des poils du pubis et durant le ralentissement de la poussée de la croissance (Kliś et al., 2016). Par rapport aux événements marquant le processus de la maturation sexuelle chez la fille, la ménarche constitue un événement identifiable et mémorable dans la vie de chaque fille, ce qui le qualifie comme marqueur de la puberté dans les études épidémiologiques. Cependant, il existe une grande variabilité dans le timing de la ménarche entre les populations à travers le monde. Bien que le timing des premières règles soit héréditaire dans une certaine mesure (Matchock et al., 2004), il peut tout de même être lié aux conditions environnementales et socio-économiques au niveau des populations. Dans la littérature, il n’y avait pas d’accord sur les seuils spécifiques définissant une ménarche précoce. Certaines études ont défini la ménarche précoce comme un événement survenant avant les 12 ans de l’âge de la fille (Cheong et al., 2015), alors pour d’autres la ménarche précoce survient à moins de 11 ans (Mueller et al., 2015). L’une des raisons probables de l’absence d’une limite standard est la grande variabilité de l’âge moyen à la ménarche entre les populations (Jansen, 2016).
Les paramètres anthropométriques, tels que poids, l’IMC et la taille sont fortement corrélés à l'âge à la ménarche. Frisch et Revelle ont proposé un poids corporel critique lors de l'apparition des premières règles (Frisch and Revelle, 1971). En effet, il a été démontré que le taux des graisses sous-cutanées et IMC des filles pré-pubères (5-9 ans) sont associés à une ménarche précoce (< 11 ans) (Freedman et al., 2002). Egalement, il a été constaté que l’âge à la ménarche est négativement lié à la tour des hanches mais il est positivement lié à la tour de la taille (Lassek and Gaulin, 2007).
L'association du poids de naissance avec le développement pubertaire n'a pas encore bien documentés (Lazar et al., 2003 ; Ibáñez et al., 2011), bien qu’il existe quelques données qui ont montré que pour un âge gestationnel réduit, l'âge à la ménarche est avancé d’environ 5 à 10 mois, alors que chez les garçons, la puberté survient généralement à un âge approprié (Persson et al., 1999). D’autre part, Ellison a trouvé que l’âge à la ménarche est lié à la taille plutôt qu’au poids, ce qui suggère que la maturation squelettique est plus important que l'accumulation de graisse corporelle pour la survenue de la ménarche (Ellison, 1981 ; Chang et al., 2000). En fait, la ménarche a été est inversement liée aux niveaux de leptine, une hormone produite par les cellules adipeuses (Matkovic et al., 1997). En 2007, Lassek et Gaulian ont démontré que la ménarche est plus étroitement liée à la distribution des graisses et inversement aux niveaux de leptine (Lassek and Gaulin, 2007).
La puberté précoce est associée à une augmentation de l'indice de masse corporelle, au développement de la résistance à l'insuline, aux syndromes métaboliques et à un risque cardiovasculaire accru (Feng et al., 2008). En outre, les filles avec une ménarche précoce présentent une pression artérielle et une intolérance au glucose plus élevées par rapport aux à celles ayant eu une ménarche tardive (Remsberg et al., 2005). Une étude plus récente a confirmé ces observations, et elle a montré également qu’une ménarche précoce (< 12 ans) est associé significativement avec l’incidence de certaines maladies comme les maladies cardiovasculaires et le cancer (Lakshman et al., 2008).
Plusieurs études confirment que l’âge aux premières règles constitue un risque marqueur du cancer du sein (De Waard and Trichopoulos, 1988). Il a été montré que les femmes qui ont eu leur ménarche avant l’âge de 12 ans ont 23 % plus de risque de développer un cancer de seins en comparaison avec celles qui ont eu leur ménarche à 15 ans ou plus (Brinton et al., 1988 ; Key et al., 2001). Cette prédisposition est renforcée par le fait qu’une apparition précoce de la ménarche est accompagnée par une obésité abdominale et donc des niveaux plus élevés d'insuline mise en circulation, et un taux plus élevé en testostérone qui agit à son tour comme facteur de prolifération des tissus mammaires ce qui favorise la cancérogenèse des glandes mammaires (Stoll et al., 1994). D’autre part, une ménarche plus tardive est associée à l’ostéoporose, à la dépression ainsi qu’aux problèmes d’anxiété sociale (Karapanou and Papadimitriou, 2010).
L’effet de la saisonnalité sur la ménarche a été déjà signalé, de sorte que la survenue de la ménarche n’est pas répartie uniformément tout au long de l’année, il existe bien des pics en hiver et en été (Ferris et al., 2010 ; Günther et al., 2010). Les facteurs saisonniers tels que la durée de la luminosité du jour, les températures ambiantes et les effets psychologiques sur la réduction du stress ainsi que la détente pendant les vacances scolaires peuvent expliquer la variabilité observée (Ferris et al., 2010).
Le changement climatique pourrait avoir plusieurs conséquences sur le moment des règles. En particulier, il pourrait entraîner une augmentation de la libération des toxines dans l'environnement (phénomènes météorologiques extrêmes). En outre, les événements météorologiques pourraient modifier la disponibilité des cultures et de la consommation de légumes et des protéines, qui sont connues pour leur effet sur le moment de la survenue de la ménarche.
Sujets et méthodes
La présente étude a ciblé une population de 524 collégiennes et lycéennes (Marrakech) âgées de 12 à 20 ans, qui ont participé volontairement à notre étude. Le poids corporel a été mesuré à 100 g près à l’aide d’une balance mécanique portative médicale correctement tarée et suffisamment précise, dotée d’un cadran rond (Balance mécanique ADE). Pour chaque mesure, la balance a été placée sur une surface plane. Les participantes portaient des habits sportifs légers et elles ne portaient pas de chaussures. La taille a été mesurée à 1 mm près à l’aide d’une toise mobile verticale, graduée de 0,1 cm (Seca, Allemagne). La toise a été fixée à un mur vertical, le sol sur lequel reposeront les pieds est horizontal. La participante se tenait debout droitement, les talons au contact du mur et sans chaussures.
L’indice de masse corporelle (en anglais, body mass index ou index) ou indice de Quételet est de plus en plus souvent utilisé pour déterminer la présence d'un excès de poids chez les enfants et les adolescents de 2 à 17 ans (Cole et al., 2000 ; Must et Anderson, 2006). L’IMC est calculé en divisant le poids en Kg par le carré de la taille en m2 (Couet, 2001).
IMC (Kg/m2) = Poids/Taille2
L’âge de la participante est présenté par l’âge décimal obtenu en calculant la différence entre la date de l’enquête et la date de naissance de la participante. L’âge à la ménarche a été déterminé par la méthode rétrospective qui visait à demander à chaque participante de se rappeler de l’âge où les menstruations sont survenues pour la première fois, et puisque cet événement ne passe pas inaperçu chez la fille, toutes les participantes ont pu déterminer cet âge voire même connaitre la saison où la ménarche est survenue.
Ethique
Les autorisations des hautes institutions ministérielles ont été obtenues. Toutes les filles ont été informées de l’objectif et de la démarche de l’étude. La participation a été libre et volontaire. Un consentement est obtenu auprès de chaque fille ayant accepté de participer à notre étude. L’anonymat de chacune des participantes a été garanti en lui accordant un code numérique utile lors des analyses statistiques, et chacune d’entre elles avait droit de renoncer à sa participation à tout moment de l’enquête.
Résultats
La figure 1 montre la distribution générale des participantes selon l’âge de survenue de la ménarche. Il ressort de cette distribution que l’âge moyen à la ménarche auprès de la population étudiée est de 12,87±1,30 ans (IC à 95 %).
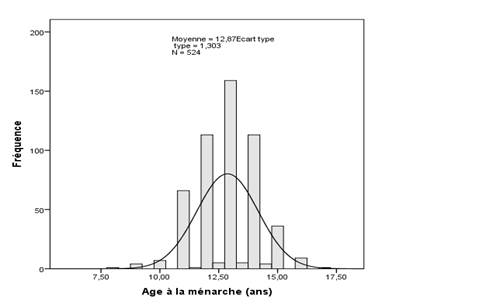
Figure 1. Répartition des participantes selon l’age à la ménarche
Figure 1. Distribution of participants according to the menarcheal age
Le tableau 1 montre la distribution des participantes selon leur âge à la ménarche et par statut de la ménarche. On peut remarquer que la ménarche précoce a été enregistrée chez 14,9 % des participantes, par contre la ménarche tardive a été enregistrée chez 9,5 % des participantes.
|
Age à la ménarche |
N (%) |
|
|
≤ 11 |
Ménarche précoce |
78 (14,9) |
|
11,01 - 12 |
Ménarche normale |
114 (21,8) |
|
12,01 - 13 |
163 (31,1) |
|
|
13,01 - 14 |
119 (22,7) |
|
|
> 14 |
Ménarche tardive |
50 (9,5) |
Tableau 1. Répartition des participantes selon le statut de la ménarche
Table1. Distribution of participants according to the status of menarche
Nous avons testé la relation possible entre la ménarche et les paramètres anthropométriques considérés dans le cadre de notre étude. Les résultats sont présentés dans le tableau 2. Il s’avère de ces résultats qu’il existe une différence statistiquement significative des moyennes de la taille (p < 0,001), du poids (p < 0,001) et de l’IMC (p < 0,001) entre les participantes réglées et celles qui ne le sont pas à la date de notre enquête. En effet, les participantes non réglées sont de plus courte taille, ont moins de poids et un faible IMC en comparaison avec celles réglées.
|
Paramètres |
Participantes non réglées (n = 280) |
Participantes réglées (n = 524) |
Valeur de p |
|
Taille (cm) |
148,35 ± 9,43 |
160,00 ± 5,51 |
0,001 * |
|
Poids (Kg) |
39,71 ± 10,83 |
55,72 ± 10,04 |
0,001 * |
|
IMC (Kg/m2) |
17,78 ± 3,46 |
21,76 ± 3,71 |
0,001 * |
Tableau 2. La ménarche et les facteurs anthropométriques associé (Test-T Student). *p < 0,05
Table 2. Menarche and associated anthropometrics factors (Test-T Student). *p < 0.05
Pour mesurer l’association entre l’âge à la ménarche et les paramètres anthropométriques nous avons réalisé une analyse de corrélation multivariée (corrélation de Pearson). Les résultats sont représentés dans le tableau 3.
|
Variables |
Poids (Kg) |
Taille (cm) |
IMC (Kg/m2) |
|
Age à la ménarche (ans) |
r = -0,061 |
r = 0,061 |
r = -0,091 |
|
p = 0,161 |
p = 0,164 |
p = 0,038* |
Tableau 3. La corrélation entre l’âge à la ménarche et quelques paramètres anthropométriques (Pearson). *p<0,05
Table 3. Association between age at menarche and some anthropometric’s parametrs (Pearson). *p<0.05
Il existe une association significativement négative entre l’IMC et l’âge à la ménarche (r = -0,091, p < 0,05) montrant que l’âge à la ménarche est précoce chez les filles ayant un IMC élevé et il est tardif chez les filles dont l’IMC est faible. En revanche, l’âge à la ménarche ne montre pas relation linéaire avec le poids et à la taille.
Nous avons jugé essentiel de subdiviser les participantes en trois groupes selon la survenue de la ménarche (précoce ou tardive) et de vérifier l’influence des variables anthropométriques considérées sur les groupes étudiés (Tableau 4). Il s’avère des résultats obtenus qu’il n’y a pas une différence statistiquement significative de l’IMC calculé entre les deux groupes prédéfinis (p = 0,094). Dans le même sens, on note l’absence d’une différence statistiquement significative des moyennes de la taille et les deux groupes étudiés (p = 0,467). En revanche, si on compare les moyennes de la taille obtenues entre le premier groupe (ménarche précoce) et le deuxième groupe (ménarche tardive), on peut très bien remarquer que les participantes réglées à un âge précoce ont une taille plus faible que celles réglées tardivement (p < 0,05).
|
|
Taille (cm) |
Poids (Kg) |
IMC (Kg/m2) |
|
Ménarche précoce |
159,45 ± 4,95 |
56,87 ± 10,74 |
22,35 ± 3,95 |
|
Ménarche tardive |
161,71 ± 5,65 |
55,55 ± 8,88 |
21,23 ± 3,17 |
|
Valeur de p (Test T) |
0,019* |
0,467 |
0,094 |
Tableau 4. Statut de la ménarche (précoce, tardive) accordé aux paramètres anthropométriques. *p<0,05
Table 4. Status of menarche (early, late) according to the anthropmetrics parametrs Signification statistique. *p<0,05
La distribution des participantes selon la saison de la survenue de leur ménarche est donnée sur la figure 2. On note très bien que l’hiver constitue la saison où la ménarche survient le plus fréquemment (49 %) suivie par l’été avec une fréquence de 34,4 %. Le printemps est la saison avec la fréquence d’apparition des règles la plus faible (4,4 %).
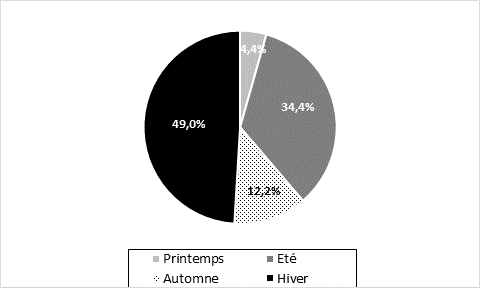
Figure 2. Distribution des participantes selon la saison de la survenue de la ménarche
Figure 2. Distribution of participants according to the season of menarche
La répartition des participantes selon leur âge moyen à la ménarche accordé à la saison de la naissance et à la saison à la ménarche, est représentée sur le tableau 5. Il ressort des résultats qu’il n’existe pas une différence statistiquement significative de l’âge moyen à la ménarche selon la saison de la naissance (p = 0,227) ou encore selon la saison à la ménarche (p = 0,059). Tout de même, l’âge à la ménarche le plus tardif est enregistré auprès des participantes qui sont nées ou qui ont eu leur ménarche au printemps (12,96 ± 1,26 ans).
|
|
Age à la ménarche (moyenne ± ET) |
p (Test d’ANOVA) |
|
Saison de la naissance |
|
|
|
Printemps |
12,96 ± 1,26 |
p = 0,227 |
|
Eté |
12,95 ± 1,31 |
|
|
Automne |
12,69 ± 1,24 |
|
|
Hiver |
12,90 ± 1,37 |
|
|
Saison à la ménarche |
|
|
|
Printemps |
12,96 ± 1,26 |
p = 0,059 |
|
Eté |
12,79 ± 1,19 |
|
|
Automne |
12,90 ± 1,28 |
|
|
Hiver |
12,92 ± 1,39 |
Tableau 5. Répartition de l'âge moyen à la ménarche selon la saison de la naissance et la saison à la ménarche
Table 5. Distribution of the mean age at menarche according to the season of birth and the season of menarche
La figure 3 donne la répartition de l’âge moyen à la ménarche selon le mois de la naissance de la participante. On remarque qu’il y a une fluctuation mensuelle de l’âge moyen à la ménarche, mais il n’existe pas une différence statistiquement significative dans la moyenne de cet âge enregistrée pour chaque mois de naissance bien que la moyenne la plus élevée (13,14 ans) et la moyenne la plus faible (12,60 ans) soient enregistrée successivement auprès des participantes qui sont nées en février et auprès de celles qui sont nées en juin.
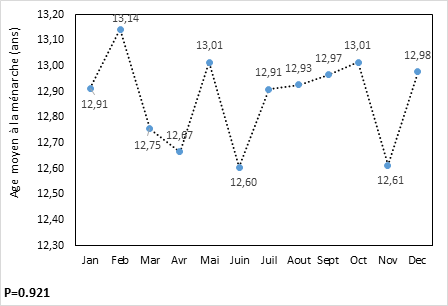
Figure 3. Répartition de l'âge moyen à la ménarche selon le mois de naissance
Figure 3. Distribution of the age at menarche according to the month of birth
Nous avons jugé essentiel de tester l’effet de la saisonnalité sur les trois classes de la ménarche prédéfinies (Tableau 6). Il ressort des résultats de l’analyse que le statut de la ménarche est influencé par la saison à la ménarche (p < 0,05) mais pas par la saison de la naissance (p = 0,880). En effet, la ménarche tardive est surtout enregistrée auprès des participantes qui ont eu leur ménarche en hiver (70 %).
|
Statut de la |
Saison de la naissance |
Saison à la ménarche |
||||||
|
ménarche |
Printemps |
Eté |
Automne |
Hiver |
Printemps |
Eté |
Automne |
Hiver |
|
Ménarche précoce |
14 (17,9) |
21 (26,9) |
19 (24,4) |
24 (30,8) |
4 (5,1) |
27 (34,6) |
9 (11,5) |
38 (48,7) |
|
Ménarche normale |
82 (20,7) |
101 (25,5) |
96 (24,2) |
117 (29,5) |
17 (4,3) |
147 (37,1) |
48 (21,1) |
184 (46,5) |
|
Ménarche tardive |
8 (16) |
15 (30) |
9 (18) |
18 (36) |
2 (4) |
6 (12) |
7 (14) |
35 (70) |
|
Valeur de p |
0,880 |
0,036* |
||||||
Tableau 6. Répartition du Statut de la ménarche (N et %)
selon la saison de la naissance et la saison à la ménarche (Test ![]() ) *p<0,05
) *p<0,05
Table 6.
Distribution of the menarcheal status (N and
%)
according to the season of birth and to the season of menarche (Test ![]() ) *p<0.05
) *p<0.05
Discussion
Parmi les principaux objectifs de notre étude était d’évaluer les facteurs qui sont associés à l’âge de la survenue de la ménarche et les paramètres anthropométriques. D’une manière générale, les paramètres anthropométriques sont plus élevés chez les participantes post réglées en comparaison avec celles préréglées. Cette constatation est en accord avec celui montré par une étude menée au Bénin (Osemwenkha and Osaikhuwuomwan, 2014). Notre étude a révélé que l’IMC est négativement corrélé à l’âge à la ménarche. Ce résultat est en accord avec celui trouvé dans le cadre d’autres études (Hossain et al., 2013 ; Al-Awadhi et al., 2013 ; Pramanik et al, 2015).
Notre étude indique que les participantes qui ont eu leur ménarche ont significativement un poids plus élevé, une taille et un IMC plus importants en comparaison avec celles qui n’ont pas encore eu leur ménarche. Ce résultat est cohérent avec celui reporté par des études précédentes menées dans des pays développés et des pays en développement (Abioye-Kuteyi, 2000 ; Dare et al, 2000 ; Kaplowitz et al., 2001).
En général, les pédiatres déclarent que les filles ayant eu une ménarche précoce ont une taille plus petite en comparaison avec celles ayant vécu leur ménarche tardivement. Notre étude n’a pas montré une corrélation absolue entre la taille et l’âge à la ménarche. Cependant si on compare la taille des participantes avec une ménarche précoce avec celles ayant eu une ménarche tardive on trouve bien une différence significative : la taille des participantes ayant eu une ménarche précoce est, en effet, plus faible par rapport à celles qui l’ont eu tardivement. Cette constatation est supportée par d’autres études (Dare et al., 1992 ; Hossain et al., 2013 ; Wahab et al., 2020). Dans notre étude le poids n’est pas corrélé à l’âge à la ménarche. Cette constatation a été déjà prouvée par Ellison (1981) qui avait lié l’âge à la ménarche plutôt à la taille qu’au poids.
Des études ont mentionné que chaque retard de la ménarche d’un an est associé à une augmentation de 0,18 cm de la taille finale atteinte par la fille (Berkey et al., 2000). Au Royaume-Uni, une étude a montré une augmentation de la taille de 0,59 cm pour une année de ménarche retardée (Yousefi et al., 2013).
Notre étude a montré qu’il y a une apparente incidence de la survenue de la ménarche en hiver. Une constatation similaire a été faite par Rah et al (2009) au Bangladesh où il a observé qu’environ la moitié des adolescentes ont eu leur ménarche en hiver. Dans le même sens, une autre étude menée en Italie a rapporté que la ménarche a des pics de fréquence en janvier et d’octobre au février (Gueresi, 1997). Park et al (1999) avaient constaté que la ménarche survient plus fréquement pendant les vacances scolaires. Une autre étude a montré que la ménarche est plus fréquente en automne qu’en hiver et au printemps (Ersoy et al., 2004). En Europe, la survenue de la ménarche présente deux pics l’un en hiver et l’autre en été (Gueresi, 1997). Le pic de l’été pourrait être dû à un effet direct de la phyto-stimulation du système hypothalamo-hypophysaire. Les femmes qui ont eu leur ménarche durant l’été passaient plus de temps à l’extérieur et être exposé à la lumière du soleil (Wehr, 1997, 1998). Quant au pic hivernal de la survenue de la ménarche, il a été expliqué par l’augmentation de la consommation alimentaire dans certains pays où l'apport énergétique moyen passe de 6,5 MJ par personne et par jour à 8,3 MJ par personne par jour pendant la saison des récoltes qui coïncide avec l’hiver (Valenzuela et al., 1996). Une autre explication possible pourrait être les effets psychologiques de la réduction du stress dû aux vacances scolaires. Pendant la saison scolaire, les adolescentes ont des devoirs et des examens réguliers ce qui pourrait contribuer à l'augmentation niveau de stress. Ainsi, une atmosphère relaxante et moins stressante pendant les vacances scolaires a été postulée pour déclencher l'apparition de la ménarche en influençant le hypothalamus (Balasuriya et Fernando, 1988).
Par ailleurs, la saison à la naissance ne semble pas avoir une influence sur le timing de la ménarche ce qui est en concordance avec une étude récente menée en Indonisie (Sohn, 2018). En revanche, les résultats d’une autre étude ont montré que les filles nées en été atteignent leur maturité sexuelle plus précocement par rapport à celles nées durant les autres saisons de l’année (Kliś et al., 2016).
Références
Abioye-Kuteyi, E. A. 2000. Menstrual knowledge and practices amongst secondary school girls in lle lfe, Nigeria. The journal of the Royal Society for the Promotion of Health, 120(1), 23-26.
Al-Awadhi, N., Al-Kandari, N., Al-Hasan, T., AlMurjan, D., Ali, S., Al-Taiar, A. 2013. Age at menarche and its relationship to body mass index among adolescent girls in Kuwait. BMC public health, 13(1), 1-7.
Balasuriya, S., Fernando, M. A. 1988. Seasonal variation of menarche in Sri Lanka. The Ceylon Medical Journal, 33(3), 105-109.
Berkey, C. S., Gardner, J. D., Lindsay Frazier, A., Colditz, G. A. 2000. Relation of childhood diet and body size to menarche and adolescent growth in girls. American Journal of Epidemiology, 152(5), 446-452.
Brinton, L. A., Schairer, C., Hoover, R. N., Fraumeni, J. F. 1988. Menstrual factors and risk of breast cancer. Cancer Investigation, 6(3), 245-254.
Chang, S. H., Tzeng, S. J., Cheng, J. Y., Chie, W. C. 2000. Height and weight change across menarche of schoolgirls with early menarche. Archives of Pediatrics and Adolescent Medicine, 154(9), 880-884.
Cheong, J. I., Lee, C. H., Park, J. H., Ye, B. J., Kwon, K. A., Lee, Y. S., Yoo, J. H. 2015. The effect of early menarche on the sexual behaviors of Korean female adolescents. Annals of Pediatric Endocrinology & Metabolism, 20(3), 130.
Cole, T. J., Bellizzi, M. C., Flegal, K. M., Dietz, W. H. 2000. Establishing a standard definition for child overweight and obesity worldwide: International survey. British Medical Journal, 320(7244), 1240-1243.
Couet, C. 2001. Exploration de l’état nutritionnel. In: Traité de nutrition clinique de l’adulte, Flammarion, Paris, France.
Dare, FO, Ogunniyi, S., Makinde, O. 1992. Biosocial factors affecting menarche in a mixed Nigerian population. Central African Journal of Medicine, 38(2), 77-81.
De Waard, F., Trichopoulos, D. 1988. A unifying concept of the aetiology of breast cancer. International Journal of Cancer, 41(5), 666-669.
Ellison, P. T. 1981. Prediction of age at menarche from annual height increments. American Journal of Physical Anthropology, 56(1), 71-75.
Ersoy, B., Balkan, C., Gunay, T., Onag, A., Egemen, A. 2004. Effects of different socioeconomic conditions on menarche in Turkish female students. Early Human Development, 76(2), 115-125.
Feng, Y., Hong, X., Wilker, E., et al. 2008. Effects of age at menarche, reproductive years, and menopause on metabolic risk factors for cardiovascular diseases. Atherosclerosis, 196(2), 590-597.
Ferris, J. S., Flom, J. D., Tehranifar, P., Mayne, S. T., Terry, M. B. 2010. Prenatal and childhood environmental tobacco smoke exposure and age at menarche. Paediatric and Perinatal Epidemiology, 24(6), 515-523.
Freedman, D. S., Khan, L. K., Serdula, M. K., Dietz, W. H., Srinivasan, S. R., Berenson, G. S. 2002. Relation of age at menarche to race, time period, and anthropometric dimensions: the Bogalusa Heart Study. Pediatrics, 110(4), e43.
Frisch, R. E., Revelle, R. 1971. Height and weight at menarche and a hypothesis of menarche. Archives of disease in childhood, 46(249), 695-701.
Gueresi, P. 1997. Monthly distribution of menarche in three provinces of north Italy. Annals of Human Biology, 24(2), 157-168.
Gunther, A. L., Karaolis-Danckert, N., Kroke, A., Remer, T., Buyken, A. E. 2010. Dietary protein intake throughout childhood is associated with the timing of puberty. The Journal of Nutrition, 140(3), 565-571.
Hossain, M. G., Wee, A. S., Ashaie, M., Kamarul, T. 2013. Adult anthropometric measures and socio-demographic factors influencing age at menarche of university students in Malaysia. Journal of Biosocial Science, 45(5), 705-717.
Ibáñez, L., Lopez-Bermejo, A., Diaz, M., Marcos, M. V., de Zegher, F. 2011. Early metformin therapy to delay menarche and augment height in girls with precocious pubarche. Fertility and Sterility, 95(2), 727-730.
Jansen, E. C. 2016. Early-Life Determinants of the Age at Menarche. Doctoral dissertation.
Kaplowitz, P. B., Slora, E. J., Wasserman, R. C., Pedlow, S. E., Herman-Giddens, M. E. 2001. Earlier onset of puberty in girls: relation to increased body mass index and race. Pediatrics, 108(2), 347-353.
Karapanou, O., Papadimitrio, A. 2010. Determinats of Menarche. Reproductive Biology and Endocrinology, 8(1), 1–8.
Key, T. J., Verkasalo, P. K., Banks, E. 2001. Epidemiology of breast cancer. The Lancet Oncology, 2(3), 133-140.
Kliś, K., Jarzebak, K., Borowska‐Strugińska, B., Mulawa, A., Żurawiecka, M., Wronka, I. 2016. Season of birth influences the timing of first menstruation. American Journal of Human Biology, 28(2), 226-232.
Lakshman, R., Forouhi, N., Luben, R., Bingham, S., Khaw, K., Wareham, N., Ong, K. K. 2008. Association between age at menarche and risk of diabetes in adults: results from the EPIC-Norfolk cohort study. Diabetologia, 51(5), 781-786.
Lassek, W. D., Gaulin, S. J. 2007. Menarche is related to fat distribution. American Journal of Physical Anthropology, 133(4), 1147-1151.
Lazar, L., Pollak, U., Kalter-Leibovici, O., Pertzelan, A., Phillip, M. 2003. Pubertal course of persistently short children born small for gestational age (SGA) compared with idiopathic short children born appropriate for gestational age (AGA). European journal of endocrinology, 149(5), 425-432.
Matchock, R. L., Susman, E. J., Brown, F. M. 2004. Seasonal rhythms of menarche in the United States: correlates to menarcheal age, birth age, and birth month. Women's Health Issues, 14(6), 184-192.
Matkovic, V., Ilich, J. Z., Skugor, M., et al., 1997. Leptin is inversely related to age at menarche in human females. The Journal of Clinical Endocrinology & Metabolism, 82(10), 3239-3245.
Mueller, N. T., Jacobs Jr, D. R., MacLehose, R. F., Demerath, E. W., Kelly, S. P., Dreyfus, J. G., Pereira, M. A. 2015. Consumption of caffeinated and artificially sweetened soft drinks is associated with risk of early menarche. The American Journal of Clinical Nutrition, 102(3), 648-654.
Must, A., Anderson, S. E. 2006. Body mass index in children and adolescents: considerations for population-based applications. International Journal of Obesity, 30(4), 590-594.
Osemwenkha, A. P., Osaikhuwuomwan, J. A., Chukwudi, E. O. 2014. Age at menarche among secondary school girls in an urban population of Nigeria. Nigerian Journal of Experimental and Clinical Biosciences, 2(2), 95.
Park, H. P. S. H., Shim, K. S. Y. K., Kim, S. K. H. S., Eun, L. E. B. L. 1999. Age and seasonal distribution of menarche in Korean girls. Journal of Adolescent Health, 25(2).
Persson, I., Ahlsson, F., Ewald, U., Tuvemo, T., Qingyuan, M., Rosen, V. D., Proos, L. 1999. Influence of perinatal factors on the onset of puberty in boys and girls: implications for interpretation of link with risk of long term diseases. American Journal of Epidemiology, 150(7), 747-755.
Pramanik, P., Rakshit, S., Saha, P. 2015. Physical determinants of early menarche: Study of age at menarche and anthropometric measures in Bengali Girls. Scholars Journal of Applied Medical Sciences, 3(2C), 723-29.
Rah, J. H., Shamim, A. A., Arju, U. T., Labrique, A. B., Rashid, M., Christian, P. 2009. Age of onset, nutritional determinants, and seasonal variations in menarche in rural Bangladesh. Journal of Health, Population and Nutrition, 27(6), 802-807.
Remsberg, K. E., Demerath, E. W., Schubert, C. M., Chumlea, W. C., Sun, S. S., Siervogel, R. M. 2005. Early menarche and the development of cardiovascular disease risk factors in adolescent girls: the Fels Longitudinal Study. The Journal of Clinical Endocrinology & Metabolism, 90(5), 2718-2724.
Sohn, K. 2018. No relationship between birth season and age at menarche in Indonesia. Anthropologischer Anzeiger; Bericht uber die biologisch-anthropologische Literatur, 75(3), 225-232.
Stoll, B. A., Vatten, L. J., Kvinnsland, S. 1994. Does early physical maturity influence breast cancer risk?. Acta Oncologica, 33(2), 171-176.
Valenzuela, C. Y., Srikumari, C. R., Gopinath, P. M., Ghose, N., Gajalakshmi, P., Csoknyay, J. 1996. New evidence of non seasonal factors in the menarche rhythm. Biological Research, 29, 245-252.
Wahab, A., Wilopo, S. A., Hakimi, M., Ismail, D. 2020. Declining age at menarche in Indonesia: a systematic review and meta-analysis. International Journal of Adolescent Medicine and Health, 32(6).
Wehr, T. A. 1997. Melatonin and seasonal rhythms. Journal of Biological Rhythms, 12(6), 518-527.
Wehr, T. A. 1998. Effect of seasonal changes in daylength on human neuroendocrine function. Hormone Research in Paediatrics, 49(3-4), 118-124.
Yousefi, M., Karmaus, W., Zhang, H., Roberts, G., Matthews, S., Clayton, B., Arshad, S. H. 2013. Relationships between age of puberty onset and height at age 18 years in girls and boys. World Journal of Pediatrics, 9(3), 230-238.