
Merabet, M., Aouragh, R., Idrissi, A., 2018. Les
méningites bactériennes aigues communautaires chez les enfants de moins de 5
ans à la région Tanger-Tétouan-Al Hoceima (Maroc) 2006-2015 : Profil
épidémiologique, clinique et biologique. Antropo, 40, 1-11.
www.didac.ehu.es/antropo
Les méningites bactériennes aigues
communautaires chez les enfants de moins de 5 ans à la région Tanger-Tétouan-Al
Hoceima (Maroc) 2006-2015 : Profil épidémiologique, clinique et biologique
Community-acquired
acute bacterial meningitis in children under 5 Years in the Tangier-Tétouan-Al
Hoceima region (Morocco) 2006-2015: Epidemiological, clinical and biological
profile
M. Merabet1, R. Aouragh2,
A. Idrissi3
1 Direction
d’Epidémiologie et de la Lutte contre les Maladies-Rabat-Maroc.
2
Délégation provinciale de la santé, Al Hoceima- Maroc
3 Ecole
nationale de santé publique-Rabat- Maroc.
Auteur
correspondant: Docteur Mouad Merabet, Direction d’Epidémiologie
et de la Lutte contre les Maladies, Rabat, Maroc. meynet234@yahoo.fr.
Mots clés : Enfants ;
Létalité ; Méningite bactérienne ;Neisseria Meningitidis.
Keywords: Bacterial Meningitis; Children; Lethality; Neisseria Meningitidis.
Résumé
La méningite bactérienne chez l’enfant est une urgence médicale et de santé publique.
C’est un problème de santé au Maroc et à la région Tanger-Tétouan-Al Hoceima
(RTTA). L’objectif de ce travail est de décrire le profil épidémiologique,
clinique et cyto-chimique de la maladie chez les enfants de moins de 5 ans à la
RTTA.
Il s’agit d’une étude rétrospective à visée descriptive d’une série
de cas clinique. La population cible était les cas de méningite bactérienne
enregistrés chez les enfants de moins de 5 ans au niveau de la RTTA entre 2006
et 2015. Les données ont été collectées à partir de la base de données
régionale des méningites. L’analyse
des données a été réalisée à travers le logiciel Epi-Info 7.
Ont été inclus dans l’étude 721 cas avec une incidence moyenne 23/100.000
enfants. L’âge médian était de 19 mois et le
sex-ratio M/F était de 1,36. Le syndrome méningé fébrile a été observé
dans 32,90% des cas. Le LCR était trouble dans 78,24% des cas. Le nombre médian
de GB était 1400 éléments/mm3. Le taux de confirmation était de
27,18%. Les cas confirmés étaient causés par Neisseria Méningitidis (140),
Streptocoque Pneumonae (33) et
Haemophilus Influenzae (18). La létalité moyenne était de 11,79%.
La méningite
bactérienne est un réel problème de santé à la RTTA notamment chez l’enfant,
nécessitant l’implication
de l’ensemble du personnel de santé et de la communauté dans les actions de
lutte, l’allocation de ressources nécessaires et le suivi régulier des mesures
entreprises.
Abstract
Bacterial meningitis in children is a
medical and public health emergency. It is a health problem in Morocco and the
Tangier-Tetouan-Al Hoceima region (TTAR). The objective of this work is to
describe the epidemiological, clinical and cytochemical profile of this disease
in children under 5 years at TTAR.
This is a retrospective descriptive study
of a series of clinical cases. The target population was the cases of bacterial
meningitis recorded in children under 5 years at TTAR between 2006 and 2015.
Data were collected from the regional meningitis database. The data was analyzed
using the Epi-Info 7 software.
Were included in the study 721 cases with
an average incidence of 23 / 100,000 children. The median age was 19 months and
the sex ratio M / F was 1.36. Febrile meningeal syndrome was observed in 32.90%
of cases. CSF was purulent in 78.24% of cases. The median number of GB was 1400
elements / mm3. The confirmation rate was 27.18%. Confirmed cases were caused
by Neisseria Meningitidis (140), Streptococcus Pneumonae (33) and Haemophilus
Influenzae (18). The mean lethality was 11.79%.
Bacterial meningitis is a real health problem in TTAR especially in
children, requiring the effective involvement of all health personnel and
community in the control actions, the allocation of necessary resources and the
follow-up measures taken.
Introduction
La méningite est une inflammation des enveloppes cérébrales entrainant des anomalies du liquide céphalo-rachidien (LCR), (Stahl, 2013). Dans la plupart des cas, elle est d’origine infectieuse, mais elle peut être le résultat d’un traumatisme, d’un cancer ou d’un médicament. (CDC, 2017a). Habituellement aigues, les méningites peuvent être chroniques dans moins de 10% des cas avec persistance du processus inflammatoire au-delà de 4 semaines (Houillier et al. 2015) Les méningites infectieuses aigues communautaires constituent une double urgence, à la fois médicale à cause de la létalité élevée des méningites bactériennes notamment chez les nourrissons et les enfants de bas âge (Kim, 2010) et de santé publique, à cause du grand risque épidémique des méningites méningococciques (MM) qui sont les plus susceptibles de provoquer des épidémies importantes. En effet, si les formes virales sont en règle générale d'évolution bénigne et spontanément guérissables chez l’immunocompétent (Stahl, 2012), les méningites bactériennes représentent les formes les plus graves de cette maladie. On estime que plus de 1,2 millions de cas de méningite bactérienne se reproduisent chaque année dans le monde (WHO and CDC, 2011).Chez l’enfant et en dehors de la période néonatale, trois bactéries sont responsables de la plupart des cas des méningites bactériennes. Il s’agit de Neisseria meningitidis (NM), de Streptocoque pneumoniae (SP) et d’Haemophilus Influenzae (HI) (Scheld et al, 2002). Avec le développement de la vaccination et avec les diverses recommandations de bonnes pratiques médicales concernant essentiellement l’antibiothérapie adoptées ces dernières années, de nettes modifications du profil bactériologique des méningites bactériennes de l’enfant ont été observées dans plusieurs pays du monde (Levy et al, 2008).
Actuellement,
la méningite bactérienne la plus fréquente est
celle due à NM. Elle sévit à
l’état sporadique ou endémo-épidémique dans la quasi-totalité des pays du
monde, et c'est dans la ceinture africaine de la méningite, qui s'étend du
Sénégal à l'ouest jusqu'à l'Éthiopie à l'est, que l'on enregistre les taux les
plus élevés de prévalence avec des risques de propagation aux autres pays de la
planète (OMS, 2015).
Au
Maroc, les méningites constituent un des principaux problèmes de santé publique
dus aux maladies transmissibles. Elles sévissent à l’état endémo-sporadique
avec émergence de temps à autres de micro-foyers épidémiques de méningites
méningococciques et virales. Le profil épidémiologique est dominé par la
méningite à méningocoque dont le sérogroupe dominant est le B. Le taux de
létalité reste élevé et varie selon l’agent pathogène en cause, en moyenne de 8
à 12% par an (Ministère de la santé - Maroc, 2010). Cette létalité est
particulièrement élevée chez les groupes les plus vulnérables, dont les enfants
de moins de 5 ans chez qui les
méningites aigues étaient responsables de 2,7% de causes de décès en 2014,
contre 0,2% chez la population générale (Ministère de la santé - Maroc, 2015)
Au
niveau de la région Tanger-Tétouan-Al Hoceima (RTTA), les méningites aigues
communautaires sont parmi les problèmes de santé prioritaires. Une stratégie
régionale de prévention et de lutte est mise en place afin de réduire la
morbi-mortalité de ce véritable problème de santé. Mais, malgré les efforts
fournis, l’incidence et la létalité de cette maladie restent loin des objectifs
nationaux, notamment chez l’enfant.
C’est
en partant de ces constats que nous avons décidé de mener ce travail ayant
comme objectif de decrire le profil épidémiologique, clinique,
biologique, et l’évolution des méningites bactériennes aigues communautaires
chez les enfants de moins de 5 ans à la RTTA.
Matériel
et méthodes
Il s’agit d’une étude rétrospective à visée descriptive d’une série
de cas cliniques.
Population de l’étude était
l’ensemble des enfants de moins de 5 ans ayant présenté une méningite bactérienne aigue communautaire au niveau
de la RTTA pendant une période de 10 ans allant du 1ér
Janvier 2006 jusqu’au 31 Décembre 2015, et détectés par le système de
surveillance épidémiologique de cette maladie.
Définitions des cas
Méningite
bactérienne probable (MBP): tout cas suspect de méningite, avec un examen du LCR montrant au
moins un des éléments suivants : Un aspect trouble ou purulent ; des leucocytes
dans le LCR > 100 cellules / mm3 ; des leucocytes dans le LCR
entre 10 et 100 cellules/mm3, avec une protéinorachie élevée (>
1g/l) où une baisse de la glycorachie < 0,4 g/l ; ou une coloration de
Gram positive.
Méningite
méningococcique probable (MMP) : tout cas suspect de
méningite aiguë ou tout cas de MBP avec au moins un des critères suivants :
Purpura fulminans en l’absence d’une autre cause apparente ; examen direct du
LCR positif (présence de diplocoques Gram-négatif) ; ou notion de cas groupés ou d’épidémie en
cours.
Méningite
bactérienne confirmée au laboratoire : Tout cas de méningite suspect ou probable avec identification du
germe dans le LCR ou le sang par culture, antigènes solubles ou PCR.
Ont été exclus de l’étude les méningites néonatales,
les méningites tuberculeuses, et les méningites nosocomiales.
Les données ont été collectées à partir de la base de
données régionale de surveillance épidémiologique des méningites. L’analyse
a été réalisée à l’aide du logiciel Epi-Info 7. On a procédé à la description
du profil épidémiologique et microbiologique ainsi que les caractéristiques
cliniques, biologiques et évolutives de la population de l’étude à travers le
calcul des valeurs de tendances centrales ainsi que leurs mesures de
dispersion pour les variables quantitatives et le calcul des proportions pour
les valeurs qualitatives. Des tests statistiques de comparaison des proportions
et des moyennes ont été utilisés à un niveau de confiance de 95%. La production
des graphiques a été faite en utilisant L’Excel.
Considérations éthiques
Le secret professionnel a été respecté de façon stricte, et les
dispositions réglementaires en vigueur ont été respectées. L’étude s’est
déroulée sans interaction avec les personnes, ce qui a rendu le consentement
éclairé non nécessaire. L’autorisation d’effectuer l’étude a été obtenue de la
part de du directeur régional de la santé de la RTTA, et l’approbation par le
comité d’éthique de la recherche biomédicale (Faculté de Médecine et de
Pharmacie –Rabat) a eu lieu.
Résultats
Incidence et
distribution spatio-temporelle
Entre 2006 et 2015, 88,36% des
cas de méningites de l’enfant de moins de 5 ans à la RTTA étaient d’origine
bactérienne avec un total de 721 cas, ce qui a représenté 33,36 % de l’ensemble
des cas de méningites aigues communautaires survenues à la région. L’incidence
moyenne des méningites bactériennes de l’enfant de moins de 5 ans à la région
durant la période de l’étude était de 23 nouveaux cas/100.000Efts5. Elle
était plus élevée chez l’enfant de moins d’un an avec une valeur de 36/100.000
enfants. Durant la période de 10 ans sur laquelle a porté notre étude,
l’incidence a enregistré une tendance globale à la diminution, avec un
coefficient de détermination R2 de 0,545, ceci malgré l’augmentation
enregistré en 2015 (Figure 1). Chez l’enfant de moins d’un an, l’incidence a
suivi la même tendance enregistrée chez l’enfant de moins de 5 ans avec des
valeurs plus élevées, jusqu’au 2013, l’année à partir de laquelle, l’incidence
a augmenté de façon très marquée passant de 28,8/100.000 enfants à 46,5/100.000
enfants en 2015 (Figure 1).
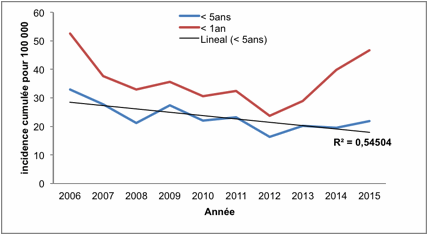
Figure 1.
Evolution de l’incidence des méningites bactériennes chez l’enfant de moins de
5 ans et de moins d’un an à la RTTA entre 2008 et 2015 (pour 100.000 enfants)
Figure1. Evolution of the
incidence of bacterial meningitis in children under 5 and under one year of age
at TTAR between 2008 and 2015 (per 100,000 children)
La distribution saisonnière des cas de méningites était caractérisée par
une diminution progressive de la fréquence relative durant l’année en passant
de 30,04% des cas enregistrés en hivers à 17,94% des cas enregistrés en automne
qui avait représenté la saison où le
nombre de cas est le plus bas. Selon le milieu de résidence, les cas ont
été répartis entre 50,28% (361) d’origine urbaine, 47,21% (339) d’origine
rurale, et 2,51% (18) de provenance semi-urbaine. 57,20% des cas étaient
résidents à moins de 20 km de l’hôpital de prise en charge, et 4,73% étaient à
plus de 80 Km. La durée nécessaire pour arriver à l’hôpital de prise en charge
était variable entre une minimale de 4 min et une maximale de 3H30mn, avec une
médiane de 20 mn (Tableau 1).
Caractéristiques
individuelles
L’âge des enfants était variable entre 1 et 58 mois, avec une médiane de
19 mois, et une tranche d’âge modale de 1 à 11 mois (33,01%). Parmi l’ensemble
des cas, 415 (57,56%) étaient de sexe masculin et 306 (42,44%) étaient de sexe
féminin, soit un sex-ratio M/F de 1,36. 5,57% des enfants malades étaient
vaccinés contre le méningococcus et 17,61% avaient reçu une antibiothérapie
avant la pratique de la ponction lombaire (Tableau 1).
Caractéristiques
cliniques
Dans l’ensemble des cas, les signes cliniques dominants étaient la fièvre
(85,55%), les vomissements (63,51 %), la
raideur de la nuque (50,85%) et les céphalées dans 39,85% des cas. Le
syndrome méningé fébrile typique (Fièvre, Céphalées, vomissements et raideur de
la nuque) a été observé dans 32,90% des cas. Les troubles de consciences (altération
de conscience ou coma) étaient présents chez 25,66% des cas, le purpura et les
convulsions étaient présentes à l’admission respectivement chez 23,58% et
18,45% des enfants. Le tableau clinique a présenté certaines particularités en
fonction de l’âge, ainsi le bombement de la fontanelle antérieure n’était
présent que chez 37,39% des nourrissions de moins d’un an, alors que les
céphalées et le syndrome méningé n’étaient observés que chez les enfants d’un
an et plus. Les signes cliniques significativement liés à l’âge d’un an et plus
étaient : la raideur de la nuque, la photophobie et le purpura, tandis que
les convulsions étaient significativement liées au nourrissons de moins d’un an
(Tableau 2).
|
Variable |
|
Effectif |
% |
|
|
Tranches
d’âge en année (n=721) |
]0,1[ |
238 |
33,01 |
|
|
[1, 2[ |
128 |
17,75 |
||
|
[2, 3[ |
106 |
14,70 |
||
|
[3,4[ |
122 |
16,92 |
||
|
[4, 5[ |
127 |
17,61 |
||
|
Saison (n=719) |
Hivers |
216 |
30,04 |
|
|
Printemps |
191 |
26,56 |
||
|
Eté |
183 |
25,45 |
||
|
Automne |
129 |
17,94 |
||
|
Milieu
(n=718) |
Urbain |
361 |
50,28 |
|
|
Rural |
339 |
47,21 |
||
|
Semi-urbain |
18 |
2,51 |
||
|
Distance
en Km entre le milieu de résidence et l’hôpital de prise en charge (n=528) |
[0,10] |
249 |
47,16 |
|
|
[11,20] |
53 |
10,04 |
||
|
[21,60] |
116 |
21,97 |
||
|
[61,80] |
85 |
16,10 |
||
|
[81,100] |
14 |
2,65 |
||
|
>100 |
11 |
2,08 |
||
|
Durée
en minutes entre le milieu de résidence et l’hôpital de prise en charge (n=498) |
<15 |
172 |
34,54 |
|
|
[15,30] |
135 |
27,11 |
||
|
[31,60] |
71 |
14,26 |
||
|
[61,90] |
61 |
12,25 |
||
|
[91,120] |
39 |
7,83 |
||
|
> 120 |
20 |
4,02 |
||
Tableau 1. Caractéristiques générales des cas de méningites
bactériennes de l’enfant à la région Tanger-Tétouan-Al Hoceima entre 2006 et
2015
Table 1. General characteristics of children's bacterial meningitis cases in the
TTAR between 2006 and 2015
|
Signes cliniques |
Enfants de moins d’un an n (%) |
Enfants d’un an et plus n (%) |
p-value |
|
Fièvre (n=713) |
205 (86,13) |
405 (85,26) |
0,755 |
|
Vomissements (n=718) |
142 (60,17) |
314 (65,15) |
0,193 |
|
Raideur de la nuque
(n=704) |
88 (39,46) |
270 (56,13) |
<0,001 |
|
Céphalées (n=389) |
- |
155(39,85) |
- |
|
Syndrome méningé fébrile
typique (n=389) |
- |
128(32,90) |
- |
|
Troubles de consciences
(n=721) dont - Altération de conscience - Coma |
52 (21,85) 42 (17,65) 10 (4,20) |
133 (27,54) 106 (21,95) 27 (5,59) |
0,100 0,179 0,427 |
|
Purpura (n=721) |
40 (16,81) |
130 (26,92) |
0,003 |
|
Convulsions (n=721) |
60(25,21) |
73 (15,11) |
<0,001 |
|
Photophobie (n=721) |
7 (2,94) |
60 (12,42) |
<0,001 |
|
Bombements de la
fontanelle (n=238) |
89 (37,39) |
- |
- |
Tableau 2. Distribution
des signes cliniques des cas de méningites bactériennes de l’enfant selon
tranches d’âge, région Tanger-Tétouan-Al Hoceima entre 2006 et 2015
Table 2. Distribution of clinical
signs of children's bacterial meningitis cases by age group, TTAR, between 2006
and 2015
Caractéristiques
cytochimiques du LCR
La proportion des enfants qui ont bénéficié d’une ponction lombaire était
de 95,33%. L’observation macroscopique du LCR a révélé une prédominance de
l’aspect trouble dans 78,24% des cas, suivi de l’aspect clair et hémorragique
dans respectivement 18,35% et 3,42% des cas. Le nombre de GB par mm3
de LCR était variable entre 10 et 56.000 avec une médiane de 1.400 et un mode de
1.200 éléments/mm3. Le pourcentage des polynucléaires neutrophiles
parmi les GB variait entre 50 et 100% avec une moyenne de 84% (+ 13%). La
glucorachie moyenne était de 0,37 g/l (+0,25
g/l) avec une minimale de 0,01 g/l, une
maximale de 1,8 g/l et un mode de 0,1 g/l. La protéinorachie moyenne était de
1,46 g/l (+1,26 g/l)
avec une minimale de 0, 1 g/l et une maximale de 10 g/l.
Profil
microbiologique
La coloration de Gram a été réalisée sur 94,42% des LCR prélevés. Elle
était négative dans 60,22% des cas et
dans 32,75% des cas, elle a révélé un diplocoque Gram -. Parmi les 721 cas de
méningites bactériennes aigues de l’enfant enregistrées à la RTTA en 10 ans,
273 (37,86%) étaient classées bactériennes probables, 252 (34,95%) classées
méningococciques probables et 196 étaient des méningites bactériennes
confirmées, soit un taux de confirmation de 27,18%. La confirmation a été faite
par la culture qui était effectuée dans 80,99% des cas et/ou par les antigènes
solubles qui ont été recherchés dans 61,87% des cas. Les cas confirmés étaient
nettement dominés par NM avec 71,43% des
cas (140 cas), suivis du SP dans 16,84% des cas (33 cas). 18 cas d’HI qui ont
été enregistrés durant la période de l’étude. Le sérogroupe de NM prédominant
était le B avec une proportion de 75,24% des cas (Tableau 3).
|
|
Type |
N |
% |
|
Coloration de Gram (n=455) |
Diplocoque Gram- |
149 |
32,75 |
|
Diplocoque Gram+ |
16 |
3,52 |
|
|
Coccobacille Gram- |
10 |
2,20 |
|
|
Cocci Gram+ en amas |
4 |
0,88 |
|
|
Bacille Gram- |
2 |
0,44 |
|
|
Négatif |
274 |
60,22 |
|
|
Classification des cas (n=721) |
Méningite Bactérienne Probable |
273 |
37,86 |
|
Méningite Méningococcique Probable |
252 |
34,95 |
|
|
Méningite méningococcique confirmée |
140 |
19,42 |
|
|
Méningite à SP |
33 |
4,58 |
|
|
Méningite à HI |
18 |
2,50 |
|
|
Méningite bactérienne confirmée à Autres
Germes |
5 |
0,69 |
|
|
Sérogroupe NM (n=105) |
B |
79 |
75,24% |
|
C |
10 |
9,52% |
|
|
W135 |
9 |
8,57% |
|
|
A |
7 |
6,67% |
Tableau 3. Profil microbiologique et classification des cas de
méningites bactériennes de l’enfant. RTTA, 2006-2015
Table 3. Microbiological profile and
classification of cases of bacterial meningitis in children. TTAR, 2006-2015
Le nombre
de nouveaux cas de méningites à HI a connu une nette diminution durant la
période 2006-2015. En effet, depuis l’année 2011 aucun nouveau cas n’a été
enregistré sauf un seul en 2014 qui a eu
lieu à la ville de Tanger chez un nourrisson de deux mois dont l’évolution
était défavorable avec décès en moins de 48 heures. Quant à l’évolution du
nombre de nouveaux cas à SP, elle a été observée une diminution entre 2009 et
2012 suivie d’une augmentation durant la période 2013-2015 (Figure 2).
Aspects
thérapeutiques et évolutifs
Le délai médian entre le début de la maladie et l’admission était de 1
jour avec deux extrêmes, le jour même de début de la maladie et 22 jours. Le
début de la PEC diagnostique et thérapeutique était dans les premières 24
heures pour 81,32% des enfants admis, entre 24H et 48H pour 12,53% des cas, et
au-delà de 48H pour 6,16% des cas. Tous
les enfants malades ont bénéficié d’un traitement antibiotique sauf 6
cas qui ont été admis dans un tableau clinique très grave évoluant très
rapidement vers le décès. Les céphalosporines 3ème génération ont
été les antibiotiques les plus prescrits par les cliniciens (90,91%), suivis de
l’Ampicilline dans 7,27% des cas. Une bi-antibiothérapie a été prescrite dans
10,10%. La durée de séjour était significativement différente entre les
survivants et les décédés (p-value <0,001). Ainsi, pour les survivants, la durée moyenne était de 11,1 jours (±3,7jours) avec un mode et une médiane de 10 jours. Pour les enfants
décédés la durée était beaucoup plus courte avec une médiane d’une journée. Le
nombre total de décès par méningites bactériennes était de 85, avec une
létalité moyenne de 11,79%. Ce taux était variable selon les classes des
méningites. Les méningites à HI et à SP ont présenté la létalité la plus élevée
avec respectivement 33,33% et 27,27%
(Tableau 4).
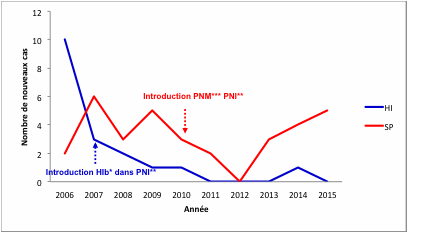
Figure 2. Evolution
du nombre de nouveaux cas de méningites à penumocoque et à Haemophilus
Influenzae, RTTA, 2006-2015. * vaccin contre l’Haemophilus Influenzae b.
** Programme National d’Immunisation. *** vaccin contre le Pneumocoque.
Figure 2. Evolution of the number of new cases of penumococcal
meningitis and Haemophilus Influenzae, TTAR , 2006-2015. *Haemophilus
Influenzae b vaccine. ** National Immunization Program. *** Pneumococcal vaccine.
|
Provinces |
Total des cas |
Total des décès |
Taux de létalité |
|
Méningite
bactérienne confirmée à Autres Germes |
5 |
0 |
0 |
|
Méningite
Bactérienne Probable |
273 |
15 |
5.49 |
|
Méningite
méningococcique confirmée |
140 |
9 |
6.43 |
|
Méningite
Méningococcique Probable |
252 |
46 |
18.25 |
|
Méningite
à SP |
33 |
9 |
27.27 |
|
Méningite
à HI |
18 |
6 |
33.33 |
Tableau 4.
Distribution du taux de létalité des méningites bactériennes de l’enfant
par type de méningite. RTTA, 2006-2015
Table 4. Distribution of the lethality rate of bacterial meningitis in children
by type of meningitis. RTTA, 2006-2015
Discussion
Entre 2006
et 2015, les cas de méningites enregistrés chez l’enfant de moins de 5 ans à la
RTTA étaient nettement dominés par l’origine bactérienne malgré que les données
de la littérature rapportent toujours les virus comme cause la plus fréquente
de méningite aiguë (Stahl, 2013; CDC, 2017b).
Cette contradiction peut être due à une sous notification des cas de méningites
virales vu leur bénignité et l’absence de déclaration obligatoire pour cette
catégorie au Maroc.
La
comparaison de l’incidence des méningites bactériennes de l’enfant de moins de
5 ans à la région durant la période de l’étude avec les autres régions du
Maroc, reste très difficile vu l’absence d’études similaires. En comparaison
avec les données internationales, l’incidence moyenne retrouvée reste inférieur
à l’incidence médiane de la région EMRO estimée à 34,3 cas/100.000Efts5
(Luksic et al, 2013). Pour
l’enfant de moins d’un an, l’augmentation de l’incidence par rapport à
l’ensemble des enfants de moins de 5 ans a été rapportée dans d’autres études,
dont celle de He et al. (2016), qui a
montré que 81,6% des cas de méningites purulentes ont été notées chez l’enfant
de moins d’un an. Ceci pourrait être expliqué par la vulnérabilité importante
aux infections chez les nourrissons de bas âge. Quant à la distribution
saisonnière, notre étude a montré que les cas surviennent tout au long de
l’année avec moins de cas en automne, ce qui concorde avec plusieurs études qui
ont démontré une saisonnalité des méningites bactériennes aussi bien chez l’enfant
que chez l’adulte. (Nuoh et
al, 2016). L’âge médian dans notre série était de 19 mois, ce qui est proche des
résultats de la série tunisienne où l’âge moyen était 18 mois (Sfaihi
et al, 2014) et la
série de l’hôpital d’enfants de Rabat (HER) dont l’âge médian était de 22 mois
(EL Amrani et al, 2016). La
prédominance masculine retrouvée dans notre cohorte concorde avec la
quasi-totalité des études (El Fakiri et al, 2016). Notre étude a révélé une faible couverture des
enfants par le vaccin anti-méningococcique qui n’a pas dépassé 5,57%, ceci est
expliqué par le fait que le dit vaccin ne fait pas partie du Programme national
d’immunisation, mais également par sa non recherche systématique lors de
l’anamnèse clinique. Nous avons retrouvé que 17,61% des enfants de notre
cohorte ont déjà reçu une antibiothérapie avant l’admission à l’hôpital de
prise en charge ce qui est en concordance avec plusieurs études notamment à
l’échelon national, dont celles de CHU
de Marrakech et de l’HER où
l’antibiothérapie préalable a été constatée dans respectivement 26% et
24,26% des cas. Ceci est expliqué par l’automédication qui est un phénomène
très fréquent au Maroc, et parfois le retard de diagnostic de la part des
médecins de première ligne surtout avec l’atypie des signes cliniques (El
Amrani et al, 2016; El Fakiri et al, 2016).
La fièvre
était un signe clinique dominant chez les enfants de notre cohorte, ce qui est
toujours rapporté dans les études. Le syndrome méningé fébrile typique a été
observé dans 32,90% des cas de notre cohorte. Dans la plupart des séries, la
fréquence de la forme clinique typique des méningites ne dépasse pas 50% chez
l’enfant. Ainsi, les données des séries de l’hôpital d’enfants de Casablanca et
de l’HER, ont montré des que le syndrome méningé a été présent dans
respectivement 43,40% et 39,5% des cas (Hamid et al, 2015; El Amrani et al, 2016).
Un
polymorphisme de la symptomatologie clinique a été constaté notamment entre les
nourrissons de moins d’un an et les enfants d’âge supérieur. Cette variabilité
rend parfois le diagnostic difficile notamment chez les nourrissons retardant
la prise en charge qui devrait être faite le plus précocement possible. Le
purpura a été retrouvée dans 23,58% des cas ce qui est inférieur aux résultats
de la série de l’HER (38,7%) et très supérieur à la série de CHU de Marrakech
où le purpura n’a été présent que dans 3% des cas (El
Amrani et al, 2016; El Fakiri et al, 2016).
Les
données cyto-chimiques de notre série concordent avec les données de la
littérature en dehors de l’absence des cas à prédominance lymphocytaire. En
effet plusieurs études ont montré que les méningites bactériennes étaient à
prédominance lymphocytaire dans plus de 50% des cas (El
Fakiri et al, 2016; He et al, 2016).
Dans notre
cohorte de 10 ans, le taux de confirmation des méningites bactériennes était
faible (27,18%). Cette faiblesse constatée dans notre série était la
conséquence de la pratique non systématique des examens de confirmation (culture,
antigènes solubles, hémoculture) mais surtout d’une négativité dominante des
résultats, ce qui suscite des questions sur la qualité de ces examens et les
conditions dans lesquelles ont été effectués. Le problème de confirmation
retentit négativement sur la qualité de la prise en charge, rend difficile et
parfois non fiable la classification des cas, et pose beaucoup de problèmes
pour la riposte. En comparaison avec les études menées à l’échelon
international, le taux de confirmation dans notre cohorte était largement
supérieur à la série palestinienne où ce taux n’a pas dépassé respectivement 3,9%
(Al Jarousha et al, 2014). Et il
était inférieur à celui de la série pakistanaise qui a atteint 49% (Khowaja
et al, 2013).
Le profil
microbiologique de notre série était partagé dans 97,45% des cas par les trois
germes classiquement rapportés dans la littérature (WHO
and CDC, 2011) : NM, SP et HI. Des différences ont été constatées en termes de part de chaque germe avec
d’autres études nationales et internationales. Ainsi nous avons trouvés que le
germe dominant de notre cohorte était NM
(71,43%) suivi de SP dans 16,54% des cas alors que la série de CHU de Marrakech
a été dominée par le SP dans 51 % des cas suivi de NM dans 40% des cas. Ces
deux germes avaient un poids égal dans la série de l’HER (34,29%) (El
Amrani et al, 2016; El Fakiri et al, 2016). Le NM et
le SP étaient responsables respectivement de 47,9% et 15,1% de la série palestinienne (Al
Jarousha et al, 2014). De même,
ils étaient responsables de 13% et de 30% des cas dans une méta-analyse
iranienne, où l’HI était le deuxième germe après le SP avec une proportion de
15% (Houri et al, 2017).
Le
sérogroupe B de NM était prédominant ce qui est le cas au niveau national (Ministère
de la santé - Maroc, 2010), et aussi au niveau de plusieurs pays du monde comme
les états unis où le Sérogroup B engendre environ 60% des cas de méningococcies
chez les enfants de moins de 5 ans (CDC, 2017c). Dans la ceinture africaine de
la méningite, le sérogroupe A représente historiquement 90% des cas de
méningococcie et la majorité des épidémies à grande échelle. Depuis
l’introduction d’un vaccin monovalent conjugué contre le méningococcique A en
2010, à travers des compagnes de vaccination de masse ciblant la tranche d’âge
1-29 ans et le début de l’introduction de ce vaccin dans le programme de
vaccination de routine pour les enfants, les épidémies dues au sérogroupe A ont
été éliminées et le nombre de cas de ce sérogroupe a enregistré une baisse
spectaculaire. Parallèlement, la proportion d’autres sérogroupes (W, X et C) et
de SP a augmenté (OMS, 2016).
La
discussion de l’évolution du nombre de cas de méningites pneumococciques reste
limitée vu qu’on n’a pas eu des données sur le statut vaccinal des enfants
malades avec absence de sérotypage des SP identifiés. Toutefois, on a
enregistré une diminution de la moyenne annuelle des cas avant et après
l’introduction du vaccin PNM passant de 4 (entre 2006 et 2009) à 2,8 (entre
2011 et 2015). Quoique, l’augmentation des cas en 2015 reste inquiétante. Une
étude avancée sur l’impact de ce vaccin s’avère nécessaire. En effet, plusieurs
études ont évalué l’impact de la vaccination PNM, dont celle faite chez les
enfants de moins de 5 ans avant et après l'introduction du vaccin PNM conjugué
à Casablanca et qui a montré une diminution significative de l'incidence de la maladie invasive pneumococcique chez
les nourrissons de moins de 2 ans, alors que chez les enfants de 2 à 5 ans,
l’incidence est restée inchangé (Diawara et al, 2015).
L’introduction
de la vaccination contre HI en 2007 au Maroc, a eu un impact rapide et
important sur le nombre de cas de méningites du à ce germe. A la RTTA, aucun
cas n’a été enregistré depuis 2011 en dehors du seul cas en 2014. Le nombre de
cas est devenu très rare dans les pays où la vaccination a été introduite, mais
l’éventualité d’une méningite à Hib, même chez des enfants correctement vaccinés
ne doit pas être écartée (Metreau et al, 2013) .
La
létalité moyenne des méningites bactériennes chez l’enfant de moins de 5 ans à
la RTTA durant la période 2006-2015 était de 11,79% ce qui est proche de la
série de l’Hôpital d’enfants de Lahore (Pakistan) où le taux de létalité était
de 10,1% (Bari et al, 2016) et
inférieure au taux retrouvé dans la série de l’HER qui était de 19,2% (El Amrani
et al, 2016), et beaucoup plus
inférieure aux taux de létalité de la série Pakistanaise qui était de 34% (Al
Jarousha et al, 2014). Alors
qu’il était largement supérieur aux données de la région EMRO-OMS entre 2005 et
2010, où le taux de létalité était de 7% chez les enfants de moins de 15 ans (Teleb
et al, 2013).
La
létalité était différente selon la classification des cas. Elle était plus élevée pour l’HI qui devient
exceptionnel avec la bonne couverture vaccinale au Marc, et pour le SP qui un
germe classiquement connue par son mauvais pronostic, et par sa mortalité et sa
morbidité infantile importante (Christie et al, 2011).
Malgré les
résultats intéressants révélés par notre travail, certains limites ont été
posées, dont la principale était le
caractère rétrospectif de l’étude, auquel s’joute le problème de données manquantes.
Conclusion
et recommandations
La
méningite aigue bactérienne communautaire est un réel problème de santé
publique à la RTTA notamment chez l’enfant. La présente étude nous a permis de
décrire l’épidémiologie, les
caractéristiques cliniques et cyto-chimiques de cette maladie à la
région, ainsi que le processus de prise en charge et le pronostique chez un
groupe vulnérable qui est l’enfant de moins de 5 ans. A la fin de ce travail
nous avons proposé des mesures d’intervention ayant comme objectif de réduire
la morbidité et la mortalité de cette affection au niveau régional. Les principales
mesures proposées sont : Le développement de la prise en charge
pré-hospitalière des cas graves ; l’amélioration du taux de confirmation ; l’amélioration de la
qualité de prise en charge hospitalière, le renforcement des activités de
prévention des méningites bactériennes (vaccination et sensibilisation) ;
et enfin l’amélioration du pilotage du programme au niveau régional et
provincial.
Remerciements.
Pr Mohammed Adnane Tazi, Ecole Nationale de santé publique-Rabat. Dr
Hicham Aoufi, Direction régionale de la santé TTA- Tétouan. Dr Germain Bukassa,
Consultant
Bibliographie
Al Jarousha, A.M., Al Afifi, A. 2014. Epidemiology
and Risk Factors Associated with Developing Bacterial Meningitis among Children
in Gaza Strip. Iranian J Publ Health. 43 (9):1176-1183.
Bari A, Zeeshan F, Zafar A, Ejaz H, Iftikhar H ,
Rathore A W. 2016. Childhood Acute Bacterial Meningitis: Clinical
Spectrum, Bacteriological Profile and Outcome. Journal of the College of
Physicians and Surgeons Pakistan. 26 (10): 822-826.
CDC 2017a. (Centers for Disease Control and Prevention).
(accessed on 27 January 2017)
Meningitis. https://www.cdc.gov/meningitis/
CDC 2017b. (Centers for Disease Control And Prevention).
(accessed on 02 April 2017) Viral
Meningitis. [Online] https://www.cdc.gov/meningitis/viral.html
CDC 2017c. (Centers for Disease Control And Prevention).
(accessed on 05 April 2017) Meningococcal Disease, Surveillance. [online]
https://www.cdc.gov/meningococcal/surveillance/index.html
Christie D, Viner RM, Knox K, et al.
2011. Long-term outcomes of
pneumococcal meningitis in childhood and adolescence. Eur
J Pediatr.170(8):997.
Diawara I, Zerouali K, Katfy K, et al. 2015. Invasive pneumococcal disease among children younger
than 5 years of age before and after introduction of pneumococcal conjugate
vaccine in Casablanca, Morocco. International Journal of Infectious Diseases,
40 : 95–101
EL
Amrani K, El Hafidi N, Barkia A, Jroundi I. 2016 . Profil épidémiologique,
clinique et facteurs pronostiques des méningites bactériennes chez des enfants
admis à l´ Hôpital d’Enfants de Rabat, Maroc Revue marocaine de santé publique
3(5) : 11-18
El
Fakiri, K., Bourrous, M., Diffo, C., Rada, N., Draiss, G., Bouskraoui, M. 2016.
Les méningites du nourrisson et de l’enfant au centre hospitalier universitaire
de Marrakech: expérience d’une unité pédiatrique marocaine. Journal de
Pédiatrie et de Puériculture, 29(5), 237-243.
Hamid, H., Amenzoui, N., Adnane, F., Ailal, F.,
Jouhadi, Z., Bousfiha, A. A., Najib, J.
2015. P-116–Le profil épidémiologique des méningites bactériennes.
Archives de pediatrie, 5(22), 262.
He Z, Li X, Jiang L. 2016. Clinical analysis on 430
cases of infantile purulent meningitis. Springerplus. 5: 1994.
Houillier
C, Verlut C, Martin-Duverneuil N , Mokhtari K,
Delattre, J.-Y. 2015 Méningites
Chroniques. EMC - Neurologie 12(2):1-22
Houri H,
Pormohammad A, Riahi S M, et al.
2017. Acute bacterial meningitis in Iran: Systematic review and
meta-analysis. PLOS ONE, 12(2): e0169617.
Khowaja A R, Mohiuddin S, Cohen A L, et al. 2013. Mortality and
Neurodevelopmental Outcomes of Acute Bacterial Meningitis in Children Aged
<5 Years in Pakistan. The Journal Of Pediatrics. 163(1, Suppl. 1) : S86-S91
Kim KS, 2010. Acute bacterial meningitis in infants
and children. Lancet Infect Dis,10 (1):32-42.
Levy,
C., Bingen, E., Aujard, Y., Boucherat, M., Floret, D., Gendrel, D., Cohen, R.
2008. Observatoire national des méningites bactériennes de l'enfant en France:
résultats de 7 années d'étude. Archives de pédiatrie, 15, S99-S104.
Luksic I, Mulic R, Falconer R, Orban M, Sidhu S &
Rudan I. 2013. Estimating global and regional morbidity from acute bacterial
meningitis in children: assessment of the evidence Croatian Medical Journal,
54( 6): 510-518
Metreau Z, Le Bars H, Desgranges-Federico M, et al. 2013. Méningites
à Haemophilus chez des enfants vaccinés
: à` propos de 3 cas. Archives de Pédiatrie. 20(issue5) : 492-495.
Ministère
de la santé - Maroc. 2010. DELM, Guide de lutte contre les méningites
bactériennes communuataires, 2010. (consulté le 28 Janvier 2017) [en ligne]
http://www.sante.gov.ma/Publications/Guides-Manuels/Documents/Guide%20m%C3%A9ningites.pdf
Ministère
de la santé - Maroc. 2015. Direction de la planification et des ressources
financières, santé en chiffre 2014, édition 2015. (consulté le 28 Janvier 2017)
[en ligne]
http://www.sante.gov.ma/Publications/Etudes_enquete/Documents/04-2016/SANTE%20EN%20CHIFFRES%202014%20Edition%202015.pdf
Nuoh RRD, Nyarko K.M, Nortey P, et al. 2016. Review of meningitis surveillance data, upper West
Region, Ghana 2009-2013. Pan African Medical Journal. 25 (Supp 1):9.
OMS.
2015. Méningites à méningocoques, Aide mémoire N° 141.( consulté le 27 Janvier
2017) [en ligne] http://www.who.int/mediacentre/factsheets/fs141/fr/
OMS.
2016. Lutte contre la méningite dans les pays de la ceinture africaine de la
méningite, 2015. Relevé épidémiologique hebdomadaire. No 16, 91, 209–216
Scheld WM, Koedel U, Nathan B and Pfister HW. 2002.
Pathophysiology of bacterial meningitis:
mechanism(s) of neuronal injury. J. Infect. Dis. S225-33
Sfaihi
L, Kamoun F, Kamoun T, et al. 2014. Les méningites purulentes
de l’enfant dans le sud Tunisien : aspects épidémiologiques et évolutifs. Tunis
Med. 92(2):141-146.
Stahl
J P. 2012. Méningites
aigues. Journal européen des urgences et de réanimation. 24(4) : 207-220.
Stahl
J P. 2013. Méningites aigues. EMC-Neurologie,
10(1) ; 17-160-C-10
Teleb N, Pilishvili T, Beneden C V, et al. 2013. Bacterial Meningitis
Surveillance in the Eastern Mediterranean Region, 2005-2010: Successes and
Challenges of a Regional Network. The journal of pediatrics.
163(Issue1) Supplement:
S25–S3.
WHO and CDC. 2011. Laboratory Methods for the
Diagnosis of Meningitis, Neisseria meningitidis, Streptococcus pneumoniae, and
Haemophilus influenza, 2011. (accessed on 27 January 2017) [online]
https://www.cdc.gov/meningitis/lab-manual/full-manual.pdf