Peña, J. A., Alfonso-Sánchez, M. A., García-Obregón,
S., Pérez-Miranda, A., 2002, Persistencia de actividad lactasa en
población residente en el País Vasco. Antropo, 3, 51-60. www.didac.ehu.es/antropo
Persistencia de
actividad lactasa en población residente en el País Vasco
Lactase
persistence in residing population of the Basque Country
Jose A. Peña,
Miguel A. Alfonso-Sánchez, Susana García-Obregón, Ana
Pérez-Miranda
Dpto. de Genética, Antropología
física y Fisiología Animal. Universidad del País Vasco.
Aptdo. 644. 48080 Bilbao. SPAIN. E-mail: ggppegaj@lg.ehu.es
Palabras clave: Hipolactasia, España, clina
Key words: Hypolactasia, Spain, cline
Resumen
La enzima lactasa (lactasa-florizin hidrolasa) permite la descomposición de la lactosa en sus dos monosacáridos, galactosa y glucosa. La persistencia de actividad lactasa es un carácter heredable, por el cual la actividad de la enzima se mantiene en la edad adulta. Su frecuencia varía en las poblaciones humanas, siendo alta sobre todo en el Norte de Europa y en algunas tribus nómadas del Norte de Africa y Próximo Oriente. La frecuencia observada de persistencia en una muestra de españoles residentes en el País Vasco es de 0,45, un valor que se encuentra dentro del rango de variación descrito para otras poblaciones del Sur de Europa. Se ha observado un significativo declive de las frecuencias de persistencia desde el Norte hacia el Sur de Europa, lo que podría deberse a la recolonización de Europa durante el Mesolítico desde los refugios del Sur, después de la última glaciación.
Abstract
Lactase (Lactase-phlorizin hydrolase) allows the digestion of lactose as its components sugars, galactose and glucose. Lactase persistence, the genetic trait in which intestinal lactase activity persists at childhood levels into adulthood, varies in frequency in different human populations, being most frequent in northern Europeans and certain African and Arabian nomadic tribes. The observed frequency of persistence in a Spanish sample residing of the Basque Country is 0.45, which falls within the range reported for other southern european populations. A clear north to south decline in persistence frequency was found in Europe. This could be an outcome of a Mesolithic reexpansion from glacial refugia in the south after the Last Glacial Maximum.
Introducción
La lactosa es un disacárido
compuesto por glucosa y galactosa que se encuentra fundamentalmente en la
leche. Para que pueda ser asimilada por los mamíferos se precisa de su
hidrólisis por la enzima lactasa (lactasa-florizin hidrolasa), que
separa ambos monosacáridos. Este proceso se realiza en el borde ciliar
de las células epiteliales del intestino.
En una parte de los seres humanos
(y en prácticamente todos los mamíferos no humanos), la actividad
lactasa intestinal decrece durante la infancia y adolescencia, hasta situarse
entre un 5-10% de la actividad observada al nacimiento. Cuando esto ocurre, se
dice que estas personas presentan hipolactasia (lactasa negativos). En otros
individuos, la actividad de la enzima continúa a niveles altos durante
la etapa adulta; estas personas muestran persistencia de actividad lactasa
(lactasa positivos). La edad a la que comienza a decrecer la actividad lactasa
es variable, pero nunca antes de los 2 años (Wang et al., 1998).
Los efectos de la ingestión
de leche entre los individuos con baja actividad lactasa incluyen
náuseas, flatulencias, diarreas y dolores abdominales. Estos
síntomas se originan por la actividad de las bacterias del colon sobre la lactosa acumulada y no
digerida. El hidrógeno que producen por su propia digestión,
junto con la acidificación del contenido del colon por los ácidos
grasos de cadena corta derivados, producen estas molestias. Su intensidad
depende de la dosis, con un amplio rango de variabilidad individual. La dosis
convencional utilizada en el test de tolerancia (50 g. de lactosa, equivalente
al contenido de 1 litro de leche) produce síntomas en un 70 a 90% de los
individuos con baja actividad lactasa, mientras que un vaso de leche los
produce en tan sólo un 30 a 60% de los casos (Bayless et al., 1975;
Bedine y Bayless, 1973; Jones et al., 1976). La hipolactasia
puede también afectar la asimilación de otros componentes de la
leche importantes en la dieta, como el calcio. Así, se ha observado una
elevada proporción de lactasa negativos entre sujetos con osteoporosis
(Birge et al., 1967; Newcomer et al., 1978), lo
que se ha atribuido bien a una evitación del consumo de leche motivada
por los síntomas descritos, o bien a un efecto deletéreo de la no
absorción de la lactosa sobre la absorción del calcio (Condon et
al.,
1970; Kocian et al., 1973; Cochet et al., 1983).
También la persistencia de actividad lactasa puede implicar consecuencias negativas. Se ha observado que la incidencia de cáncer de ovario muestra una correlación positiva significativa con el consumo de leche promedio por individuo y con la frecuencia de persistencia de actividad lactasa entre un amplio grupo de países. La causa podría encontrarse en la toxicidad de la galactosa (Cramer, 1989). Se ha encontrado asimismo una correlación significativa de la intensidad de la disminución de la fertilidad con la edad tanto con el consumo de leche como con la persistencia de actividad lactasa (Cramer et al., 1994). También parece existir un aumento del riesgo de manifestar cataratas entre los individuos lactasa positivos (Couet et al., 1991), puesto que se ha detectado una alta incidencia de cataratas seniles entre individuos con persistencia de actividad lactasa y elevados consumos de leche (Simoons, 1982; Rinaldi et al., 1984).
La hipolactasia puede ser primaria (es decir, heredable), o secundaria. La hipolactasia secundaria generalmente se debe a un decremento reversible de la actividad de la enzima asociado con problemas gastrointestinales, como pequeñas resecciones intestinales, gastrectomías, enfermedad celíaca no tratada o inflamación intestinal (Vesa et al., 2000).
La base molecular de la hipolactasia heredable todavía no ha sido desentrañada. Según algunos resultados, la herencia parece ajustarse a un modelo autosómico recesivo (Sahi y Launiala, 1977). Sin embargo, no se han observado diferencias apreciables en la secuencia de la enzima lactasa-florizin hidrolasa codificada por personas con persistencia y sin persistencia de actividad lactasa en edad adulta (Boll et al., 1991) e incluso se ha secuenciado el gen, no encontrándose diferencias asociadas a la cualidad de no persistencia (Enattah et al., 2002). De acuerdo con los resultados obtenidos por Rossi et al. (1997), el declive de la lactasa intestinal lo determinarían tanto factores transcripcionales como postranscripcionales. Wang et al., (1995) han observado que en individuos lactasa positivos, presumiblemente heterocigotos, un gen de la lactasa se expresa a niveles mucho más bajos que el otro, debido a un mecanismo regulador que actúará en forma cis. En concordancia con estos resultados, Enattah et al. (2002) han encontrado dos variantes (C/T-13910 y G/A-22018) dentro de un intervalo de 47 Kb en 2q21 asociadas con la no persistencia en un grupo de familias finesas.
Los individuos lactasa negativos
son mayoritarios en nuestra especie, pero hay algunas poblaciones, como las que
pueblan el Centro y Norte de Europa, y algunos grupos nómadas del Norte
de Africa y Próximo Oriente en las que predominan los individuos con
persistencia de actividad lactasa (Flatz, 1987). En una parte importante de los
casos, las frecuencias altas de lactasa positivos se asocian con poblaciones
que a lo largo de su historia han mantenido unas tasas elevadas de
producción y consumo de leche. Para numerosos investigadores, el alelo
responsable de la persistencia habrá alcanzado altas frecuencias por
selección natural desde el Neolítico en aquellas poblaciones que
han mantenido prácticas continuadas de pastoreo (Flatz, 1989).
Según esta hipótesis, en el Paleolítico la actividad
lactasa disminuiría en todos los individuos después del destete;
con la aparición de animales domésticos productores de leche el
alelo mutante que codifica para la persistencia de actividad lactasa
produciría una ventaja selectiva, aumentando la disponibilidad de acceso
a calorías y nutrientes, particularmente calcio, a través de la
leche. Esta ventaja se manifestaría especialmente en poblaciones con pastoreo
en condiciones nutritivas límite. También se ha propuesto una
hipótesis neutralista; para Nei y Saitou (1986), el alelo de la
persistencia apareció en el hombre antes de que se diferenciasen las
principales poblaciones humanas continentales y fue la deriva la que
posibilitó que en algunos lugares alcanzase frecuencias altas.
Según estos autores, la selección pudo haber actuado, pero de
forma posterior a este proceso.
En todo caso, la acción de
la selección puede explicar de un modo sencillo las elevadas frecuencias
de persistencia observadas en poblaciones nómadas del Norte de Africa y
Próximo Oriente. Más difíciles de aclarar son las causas
por las que se observan también altas frecuencias en poblaciones del Centro
y Norte de Europa. En Escandinavia, donde se observan los valores más
altos, la agricultura y la ganadería se introdujeron relativamente
tarde, no antes de hace 4.000 años y su economía no ha sido
particularmente dependiente de prácticas de pastoreo y producción
de leche.
En este trabajo se ha analizado la
persistencia de actividad lactasa en una muestra de población
española residente en el País Vasco, comparándose la
frecuencia obtenida con las observadas en otras poblaciones europeas, con el
fin de aportar alguna luz a la distribución de dichas frecuencias en
este continente.
Material y métodos
Los individuos analizados han sido 170 voluntarios sanos, no emparentados y residentes en el País Vasco. La muestra se ha compuesto de 67 varones y 103 mujeres, de entre 20 y 35 años.
La persistencia
de actividad lactasa se ha analizado tradicionalmente mediante tres
métodos indirectos: i) biopsias yeyunales en pacientes hospitalizados,
ii) determinaciones en serie de glucosa o galactosa en sangre después de
una ingesta de lactosa y iii) cuantificaciones del hidrógeno producido
en las tres horas siguientes a una ingesta de lactosa. Si bien la medida del
hidrógeno es menos sensible (69% de los casos identificados), los tres
métodos ofrecen una buena especificidad (96-98%) (Arola et al., 1988).
En este
trabajo se ha adoptado el método de las determinaciones en serie de
glucosa en sangre, después de una ingesta de 50 g de lactosa disuelta en
500 ml de agua. Se realizaron tres determinaciones de la concentración
de glucosa en sangre: inmediatamente antes de la ingesta y 30 y 60 minutos
después de realizada. Las mediciones se realizaron con
glucómetros Accutrend Alpha de Roche Diagnostics con sus
correspondientes tiras reactivas. Se han considerado lactasa positivos aquellos
que han mostrado un incremento de la concentración en sangre igual o
superior a 20 mg/dl (equivalente a 1,11 mmol/l).
Paralelamente,
los voluntarios analizados fueron encuestados acerca del volumen medio diario
de leche que acostumbran a tomar.
Con el
objetivo de comparar la frecuencia obtenida en la muestra analizada con las de
otras poblaciones del entorno, se seleccionaron de la bibliografía una
serie de frecuencias fenotípicas obtenidas de poblaciones europeas en
las que el tamaño muestral no fuera excesivamente pequeño. Con
esta base de datos se realizó un análisis de
autocorrelación espacial (Sokal y Oden, 1978). El estadístico que
se obtiene por este método es el índice I de Moran. Su
significación se analizó por contraste con la hipótesis
nula "no existe diferenciación geográfica" mediante un
test basado en permutaciones (Simoni et al., 1999).
Finalmente,
se analizó la posible existencia de una clina mediante correlaciones
producto-momento de las frecuencias con respecto a las coordenadas
geográficas de las poblaciones consideradas. Para una mejor
descripción, se rotaron los ejes de coordenadas hasta obtener una
correlación máxima.
Resultados
Se identificaron 77 individuos lactasa
positivos y 93 lactasa negativos, por lo que la frecuencia observada de
persistencia de actividad lactasa es de 0,45. Entre los varones, la frecuencia
es de 0,49 y entre las mujeres de 0,43. De acuerdo con estos resultados, no se
observaron diferencias significativas entre ambos sexos (G: 0,46; g.l: 1; p:
n.s.).
El
incremento medio de glucosa en sangre ha sido de 36,78 mg/dl (desviación
típica: 14,73) entre los individuos lactasa positivos y de 5,56 mg/dl
(desviación típica: 5,97) entre los lactasa negativos. Estos
valores son muy similares a los obtenidos por Gilat et al. (1970) en
varias poblaciones judías.
En la figura 1 se muestra la distribución de frecuencias del pico de incremento de glucosa en sangre entre los individuos lactasa positivos y lactasa negativos. Se observa un importante número de casos (40) en los que no se ha dado ningún incremento. Además aparecen dos modas, una en el rango 11-14 mg/dl y otra en el rango 21-25 mg/dl, correspondiendo la primera a individuos lactasa negativos y la segunda a lactasa positivos.
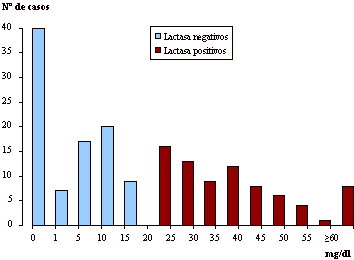
Figura 1. Distribución de frecuencias del pico de incremento de glucosa en sangre entre individuos lactasa positivos y lactasas negativos.
Figure 1. Frequency distribution of
the peak glucose rise between lactase positive and lactase negative subjects.
No se han
observado diferencias en cuanto a la ingesta promedio de leche entre los grupos
de individuos lactasa positivos (319,3 cm3, equivalente a unos 348,0
g) y lactasa negativos (318,5 cm3, equivalente a unos 347,2 g).
Entre la bibliografía consultada se encontraron casos tanto de
poblaciones en las que este mismo hecho es observado (Gilat et al., 1970)
como de poblaciones en las que la ingesta es significativamente menor entre los
individuos con hipolactasia o maldigestión (Bayless et al., 1975;
Fowkes y Ferguson, 1980).
En la
figura 2 se representan las distribuciones de frecuencias (en porcentaje) del
consumo diario de leche entre los portadores de ambos fenotipos. Si bien se
observan valores ligeramente superiores entre los individuos lactasa negativos
en las primeras clases y valores ligeramente superiores entre los individuos
lactasa positivos en las últimas clases (excepto para volúmenes
superiores a 1.000 cl.), no se han encontrado diferencias
estadísticamente significativas entre ambas distribuciones (U de
Mann-Whitney; p: 0,72; n. s.).
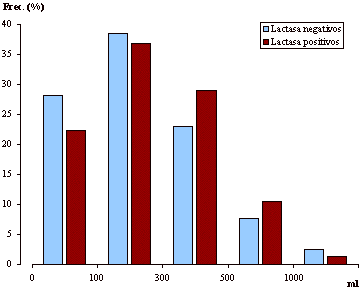
Figura 2. Distribución de frecuencias
del consumo diario de leche entre individuos lactasa positivos y lactasa
negativos.
Figure 2. Frequency distribution of
milk consumption between lactase positive and lactase negative subjects.
Con el objetivo de conocer la distribución de frecuencias de la persistencia de actividad lactasa en Europa, se recopilaron referencias sobre 30 poblaciones, configurando la base de datos que se muestra en la tabla 1.
El valor
obtenido para la población residente en el País Vasco se encuadra
perfectamente dentro del contexto del Sur de Europa, donde los valores de
persistencia son notablemente más bajos que en el Centro y Norte.
Así, se encuentran los valores mínimos en el Centro de Italia
(0,25), Turquía (0,29) y Sicilia (0,29). Por el contrario, los valores
más altos aparecen en Suecia (0,99), Dinamarca (0,97) e Irlanda (0,96).
|
Población |
Frecuencia |
|
Alemania Este |
0,780 |
|
Alemania Oeste |
0,852 |
|
Austria |
0,799 |
|
Checoslovaquia |
0,875 |
|
Chequia |
0,870 |
|
Dinamarca |
0,974 |
|
Escocia |
0,950 |
|
Eslovenia |
0,647 |
|
España
País Vasco |
0,453 |
|
Estonia |
0,720 |
|
Finlandia |
0,827 |
|
Finlandia Lapones |
0,584 |
|
Francia Norte |
0,774 |
|
Francia Sur |
0,570 |
|
Grecia |
0,470 |
|
Hungría |
0,630 |
|
Inglaterra |
0,947 |
|
Irlanda |
0,960 |
|
Italia Norte |
0,530 |
|
Italia Centro |
0,250 |
|
Italia Sur |
0,320 |
|
Sicilia |
0,290 |
|
Lituania |
0,680 |
|
Polonia |
0,626 |
|
Rumanía |
0,440 |
|
Rusia |
0,847 |
|
Suecia |
0,990 |
|
Suiza |
0,840 |
|
Turquía |
0,288 |
|
Yugoslavia |
0,490 |
Tabla 1. Distribución de la
persitencia de actividad lactasa en poblaciones europeas (Nei y Roychoudhury,
1974; Cramer, 1989; Flatz, 1989; Cramer et al., 1994).
Table 1. Distribution of the adult
lactase persistence in European populations (Nei and Roychoudhury, 1974;
Cramer, 1989; Flatz, 1989; Cramer et al., 1994).
Las diferencias observadas en la tabla 1 pudieran deberse a procesos evolutivos comunes a todo el continente o bien a alteraciones ocurridas a escala regional. Para aclarar este extremo se ha realizado un análisis de autocorrelación espacial, cuyos resultados se muestran en el correlograma de la figura 3. Dado que se trata de un polimorfismo con dos únicos fenotipos, el volumen de datos no es muy grande; por ello el índice I de Moran llega a superar el valor de 1. Sin embargo, la tendencia descendente con la distancia es muy clara. La mayor parte de los valores del índice, correspondientes a las clases de distancia 250-499, 500-749, 750-999, 1.500-2.499 y ≥2.500 son significativos. Cabe pensar por tanto en algún tipo de proceso global a escala continental para este polimorfismo, que haya dado lugar a una clina en Europa.
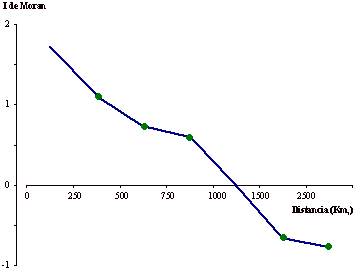
Figura 3. Correlograma espacial de
la persistencia de actividad lactasa en Europa. Los círculos indican
coeficientes significativos al nivel p < 0,001.
Figure 3. Spatial correlograms of
adult lactase persistence in Europe. Circles: Statistically significant
coefficients at p < 0.001.
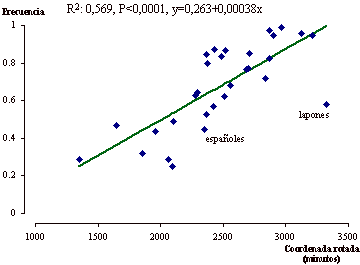
La orientación de la clina detectada se abordó inicialmente mediante sendos análisis de correlación entre las frecuencias fenotípicas y las coordenadas longitudinales y latitudinales. Se obtuvo una correlación significativa con la latitud (R: 0,67; g.l: 28; p < 0,0001), pero no con la longitud. Analizada con más detalle, se observó una significación máxima del gradiente con una orientación desde el Sur Sudeste hacia el Nor Noroeste, concretamente con una inclinación de 20 grados respecto al eje latitudinal (R: 0,75; g.l: 28; p < 0,00001). En la figura 4 se observa la recta de regresión correspondiente a esta clina. Se señalan la posición correspondiente a la muestra analizada en este trabajo y a la muestra de lapones, que a pesar de su ubicación en las regiones situadas más al Norte del continente europeo, presentan unas relativamente bajas frecuencias de actividad lactasa en adultos.
Figura 4. Distribución clinal de las
frecuencias de persistencia de actividad lactasa en 30 poblaciones europeas.
Las frecuencias fenotípicas aumentan desde el Sur Sudeste hacia el Nor
Noroeste, siguiendo la tendencia mostrada por la línea de
regresión.
Figure 4. Clinal distribution for adult lactase persistence frequencies in 30 populations from Europe. Phenotype frequencies increase from South-Southeast to North-Northwest, following the tendency shown by the regression line.
Discusión
Según
Nei y Saitou (1986), la distribución geográfica de las
frecuencias del gen responsable de la persistencia de actividad lactasa sugiere
que podría haber estado presente desde hace mucho tiempo en las
poblaciones humanas, de modo que la deriva genética habría sido
un importante factor en su diferenciación geográfica. Esta
hipótesis permitiría explicar el gradiente observado en el
continente europeo, como se verá más adelante. La existencia de
una intensa presión selectiva asociada a la ingesta de leche es por el
contrario difícil de admitir, ya que las frecuencias más altas de
persistencia se dan en Escandinavia, donde la agricultura y la ganadería
se introdujeron muy tarde, probablemente dentro de los últimos 4.000
años (Ammermann y Cavalli-Sforza, 1971). Es preciso tener en cuenta
además que las poblaciones del Norte de Europa se han caracterizado
tradicionalmente por una economía mixta de granja y pastoreo, lo que no
implica una fuerte dependencia de la leche.
Para
explicar el rápido origen de las altas frecuencias de persistencia en el
Norte de Europa se ha propuesto una hipótesis relacionada con la
absorción del calcio (Flatz y Rotthauwe, 1973), según la cual el
raquitismo y la osteomalacia habrían supuesto una importante
presión selectiva en las condiciones de baja radiación solar que
son características de esa zona. Sin embargo, partiendo de frecuencias
de un grupo de haplotipos de sitios de restricción localizados en la
región del ADN responsable de la persistencia de la actividad lactasa,
Hollox et al. (2001) concluyen que la deriva genética
ha tenido un papel muy importante modelando la diversidad en las poblaciones no
africanas, siendo la selección un proceso reciente en poblaciones del
Norte de Europa.
Una posible
explicación para la distribución de frecuencias de persistencia
de actividad lactasa observada en Europa se basa en una hipótesis
según la cual el patrimonio genético de las poblaciones europeas
se habría estructurado en su mayor parte por la
colonización de Europa desde los refugios del Sur al final de la
última glaciación, hace unos 10.000 años (Richards
et al., 1996; Torroni et al.,
1998; Peña et al., 2002). Un posible "efecto
fundador" habría dado lugar a unas frecuencias notablemente
diferentes entre el Norte y el Sur de Europa, lo que explicaría un
gradiente como el descrito en este trabajo. La penetración posterior de
la agricultura y la ganadería desde Oriente Próximo habría
determinado una presión selectiva moderada y generalizada favorable al
alelo responsable de la persistencia. La posición de los lapones en la
figura 4 se explicaría por ser una población cuya
penetración en Europa ha sido más reciente o en todo caso porque
su origen ha sido diferente y por tanto su patrimonio ha sido ajeno al efecto
fundador que experimentaron el resto de poblaciones europeas.
Los
resultados aquí discutidos subrayan la necesidad de emprender futuras
investigaciones que aborden la determinación de los haplotipos de
restricción de ADN responsables de la persistencia de actividad lactasa.
Estudios de este tipo podrían contribuir al esclarecimiento de la
interesante distribución geográfica de este polimorfismo en
poblaciones europeas.
Agradecimientos. Este trabajo ha sido
financiado por el proyecto UPV 154.310-E-14873/2002 de la Universidad del
País Vasco. M. Alfonso-Sánchez ha sido financiado por una beca
postdoctoral del "Programa de Formación de Investigadores" del
Departamento de Educación, Universidades e Investigación del
Gobierno Vasco.
Bibliografía
Ammermann,
A. J., Cavalli-Sforza, L. L., 1971, Measuring the rate of spread of early
farming in Europe. Man, 6, 674.
Arola, H.,
Koivula, T., Jokela, H., Jauhiainen, M., Keyrilainen, O., Ahola, T., Uusitalo,
A., Isokoski, M., 1988, Comparison of indirect diagnostic methods for
hypolactasia. Scandinavian Journal of Gastroenterology, 23, 351-357.
Bedine, M.
S., Bayless, T. M., 1973, Intolerance of small amount of lactose by individuals
with low lactase levels. Gastroenterology, 65, 735-743.
Bayless, T.
M., Rothfeld, B., Massa, C., Wise, L., Paige, D., Bedine, M. S., 1975, Lactose
and milk intolerance: Clinical implications. The New England Journal of
Medicine, 292, 1156-1159.
Birge, S.
J., Keutmann, H. T., Cuatrecasas, P., Wheaton, G. D., 1967, Osteoporosis,
intestinal lactase deficiency and low dietary calcium intake. The New England
Journal of Medicine, 276, 445.
Boll, W.,
Wagner, P., Mantei, N., 1991, Structure of the chromosomal
gene and cDNAs coding for lactase-phlorizin hydrolase in humans with adult-type
hypolactasia or persistence of lactase. American Journal of Human Genetics, 48,
889-902.
Cochet,
B. A., Jung, M., Griessen, P., Schaller, P., Donath, A., 1983, Effects of
lactose on intestinal calcium absorption in normal and lactase-deficient
subjects. Gastroenterology, 84, 935-940.
Condon,
J. R., Nassim, J. R., Millard, J. C., Hilbe, A., Stainthorpe, E. M., 1970,
Calcium and phosphorus metabolism in relation to lactose tolerance. Lancet, 1,
1027.
Couet,
C., Jan, P., Debry, G., 1991, Lactose and cataract in humans: a review. Journal
of the American College of Nutrition, 10, 79-86.
Cramer,
D. W., 1989, Lactase persistence and milk consumption as determinants of ovarian
cancer risk. American Journal of Epidemiology, 130, 904-910.
Cramer, D. W., Xu, H., Sahi, T., 1994,
Adult hypolactasia, milk consumption, and age-specific fertility. American
Journal of Epidemiology, 139, 282-289.
Enattah, N. S., Sahi, T., Savilahti, E.,
Terwilliger, J. D., Peltonen, L., Jarvela, I., 2002, Identification of a
variant associated with adult-type hypolactasia. Nature Genetics, 30, 233-237.
Flatz, G., 1987, The genetics of lactose
digestion in humans. Advances in Human Genetics, 16, 1.
Flatz, G., 1989, The genetic polymorphism
of intestinal lactase activity in adult humans. En The metabolic basis of
inherited disease, editado por C. R. Scriver, A. L. Beaudet, W. S. Sly y D.
Valle (New York: McGraw-Hill) pp. 2999-3006.
Flatz, G., Rotthauwe, H. W., 1973,
Lactose nutrition and natural selection. Lancet, 2, 76-77.
Fowkes, F. G. R., Ferguson, A., 1980,
Prevalence of self-diagnosed irritable bowel syndrome and cows' milk
intolerance in white and non white doctors. Scottish Medical Journal, 26, 41.
Gilat, T., Kuhn, R., Gelman, E., Mizrahy,
O., 1970, Lactase deficiency in Jewish communities in Israel. Digestive
diseases, 15, 895-904.
Hollox, E. J., Poulter, M., Zvarik, M.,
Ferak, V., Krause, A., Jenkins, T., Saha, N., Kozlov, A. I., Swallow, D. M.,
2001, Lactase haplotype diversity in the Old World. American Journal of Human
Genetics, 68, 160-172.
Jones, D. W., Latham, M. C., Kosikowski,
F. W., Woodward, G., 1976, Symptom response to lactose-reduced milk in
lactose-intolerant adults. American Journal of Clinical Nutrition, 29, 633.
Kocian, J., Skala, I., Bakos, K., 1973,
Calcium absorption from milk and lactose free milk in healthy subjects and
patients with lactose intolerance. Digestion, 9, 317.
Nei, M., Roychoudhury, A., 1974, Genic
variation within and between the three major races of Man, Caucasoids, Negroids
and Mongoloids. American Journal of Human Genetics, 26, 421-443.
Nei, M., Saitou, N., 1986, Genetic
relationship of human populations and ethnic differences in relation to drugs
and food. En Ethnic differences in reactions to drugs and other xenobiotics,
editado por W. Kalow, H. W. Goedde y D. P. Agarwal (New York: AR Liss).
Newcomer, A. D., Hodgson, S. F., McGill,
D. B., Thomas, B. J., 1978, Lactase deficiency prevalence in osteoporosis.
Annals of Internal Medicine 89, 218-220.
Peña, J. A., Alfonso-Sánchez, M. A., García-Obregón, S., Pérez-Miranda, A., 2002. Aislamiento por distancia en poblaciones europeas sobre la base de polimorfismos genéticos séricos. Antropo, 2, 31-39. www.didac.ehu.es/antropo
Richards, M., Côrte-Real, H., Forster, P., Macaulay, V., Wilkinson-Herbots, H., Demaine, A., Papiha, S., Hedges, R., Bandelt, H. J., Sykes, B., 1996, Paleolithic and Neolithic lineages in the European mitochondrial gene pool. American Journal Human Genetics, 59, 185-203.
Rinaldi, E., Albini, L., Costagliola, C.,
de Rosa, G., Auricchio, G., de Vizia, B., Auricchio, S., 1984, High frequency
of lactose absorbers among adults with idiopathic senile and presenile cataract
in a population with a high prevalence of primary adult lactose malabsorption.
Lancet, 1, 357.
Rossi, M., Maiuri, L., Fusco, M. I.,
Salvati, V. M., Fuccio, A., Auricchio, S., Mantei, N., Zecca, L., Gloor, S. M.,
Semenza, G., 1997, Lactase persistence versus decline in human adults:
Multifactorial events are involved in down-regulation after weaning.
Gastroenterology, 112, 1506-1514.
Sahi,
T., Launiala, K., 1977, More evidence for the recessive inheritance of
selective adult type lactose malabsorption. Gastroenterology, 73, 231-232.
Simoni,
L., Gueresi, P., Pettener, D., Barbujani, G., 1999, Patterns of gene flow
inferred from genetic distances in the Mediterranean region. Human Biology, 71,
399-415.
Simoons,
F. J., 1982, A geographic approach to senile cataracts: Possible links with
milk consumption, lactase activity and galactose metabolism. Digestive Diseases
and Sciences, 27, 257-264.
Sokal,
R. R., Oden, N. L., 1978, Spatial autocorrelation in biology. I. Methodology.
Biological Journal of the Linnean Society, 10, 229-249.
Torroni,
A., Bandelt, H., Dúrbano, L., Lahermo, P., Moral, P., Sellito, D.,
Rengo, C., Forster, P., Savontaus, M., Bonné-Tamir, B., Scozzari, R.,
1998, mtDNA analysis reveals a major Late Paleolithic population expansion from
Southwestern to Northeastern Europe. Am. J. Hum. Genet., 62:1137-1152.
Vesa,
T. H., Marteau, P., Korpela, R., 2000, Lactose intolerance. Journal of the
American College of Nutrition, 19, 165-175.
Wang,
Y., Harvey, C. B., Hollox, E. J., Phillips, A. D., Poulter, M., Clay, P.,
Walker-Smith, J. A., Smallow, D. M., 1998, The genetically programmed
down-regulation of lactase in children. Gastroenterology, 114, 1230-1236.
Wang,
Y., Harvey, C. B., Pratt, W. S., Sams, V. R., Sarner, M., Rossi, M., Auricchio,
S., Swallow, D. M., 1995, The lactase persistence/non-persistence polymorphism
is controlled by a cis-acting element. Human Molecular Genetics, 4, 657-662.