
Varela,
H.H., Cocilovo, J.A., O´Brien, T.G., 2012,
Evolución de las Poblaciones Prehistóricas del Área Andina Centro Sur: Deriva
Genética, Migración y Selección Natural. Antropo, 28, 9-22.
www.didac.ehu.es/antropo
Evolución de las Poblaciones Prehistóricas del Área Andina Centro Sur:
Deriva Genética, Migración y Selección Natural
Evolution of Prehistoric Populations of South Central Andean: Genetic
Drift, Migration and Natural Selection
Héctor H. Varela1, José A. Cocilovo1 y Tyler G. O´Brien2
1Departamento de Ciencias Naturales,
Facultad de Ciencias Exactas, Físico-Química y Naturales, Universidad Nacional
de Río Cuarto, 5800 Río Cuarto, Argentina.
2Department
of Sociology, Anthropology and Criminology, University of Northern Iowa, Cedar
Falls, Iowa, United States.
Correspondencia: Héctor H. Varela Departamento de Ciencias Naturales, Facultad de
Ciencias Exactas, Físico-Química y Naturales, Universidad Nacional de Río
Cuarto, 5800 Río Cuarto, Argentina. Tel: 54-358-4676167, Fax:54-358-4676230. E-mail: hvarela@exa.unrc.edu.ar
Palabras claves: poblaciones prehistóricas, deriva genética, flujo genético, selección
direccional, caracteres cuantitativos, FST.
Key words: prehistoric population, genetic drift, gene flow, directional
selection, quantitative traits, FST.
Resumen
En el presente
trabajo se pone a prueba diferentes modelos de la teoría genética cuantitativa
para evaluar si la divergencia fenotípica entre las poblaciones prehistóricas
del área Andina Centro Sur puede ser explicada sólo por la deriva genética, por
la acción combinada de este factor y la migración o si es posible advertir la
influencia de la selección natural. Para esto se aplicaron tres modelos para
poner a prueba distintas hipótesis microevolutivas. Se trabajó con un total de 455
cráneos adultos de ambos sexos, sin deformación artificial y 15 caracteres
cuantitativos, de las siguientes localidades: Cochabamba (Bolivia), Puna de
Jujuy, Selvas Occidentales (Argentina), Arica, Caleta Huelén 42, San Pedro de
Atacama, Punta de Teatinos y El Cerrito (Chile). El análisis realizado de
acuerdo con los modelos empleados indicó: 1)
que al evaluar la acción exclusiva de la deriva genética se comprobó un
exceso de variación posiblemente producida por la acción de la migración y de
la selección y 2) que el modelo de equilibrio entre deriva génica y migración reveló, en algunas poblaciones como Puna y Selvas
Occidentales, la existencia de un mayor flujo génico desde otras regiones. Si
bien, en algunas situaciones particulares no puede ser descartado el efecto de
la selección, en otras la deriva y la migración explicarían una gran parte de
la variabilidad observada entre las poblaciones, coincidiendo con las
investigaciones arqueológicas que evidencian una activa interacción biosocial a
nivel regional y extrarregional.
Abstract
In the present work
we tested different models of quantitative genetic theory to assess whether the
phenotypic divergence between prehistoric populations of South Central Andean
Area can be explained only by genetic drift, by the combined action of this
factor and migration or if it is possible to
perceive the influence of natural selection.
Three models were applied to test various microevolutionary hypotheses.
We analyzed 15 quantitative traits from 455 adult, non-deformed skulls of both
sexes from the following locations: Cochabamba (Bolivia), Puna de Jujuy and
Selvas Occidentales (Argentina), Arica, Caleta Huelén 42, San Pedro de Atacama,
Punta de Teatinos and El Cerrito (Chile). According to the models employed our
results indicated 1) that in evaluating the exclusive action of genetic drift,
any excess variation was possibly caused by the action of migration and
selection and 2) the balance of genetic drift and migration revealed, in some
populations, such as Puna and Selvas Occidentales the existence of a higher
gene flow from other regions. Although in some situations the effects of
selection cannot be ruled out; in others genetic drift and migration explain
much of the observed variability between populations, coinciding with the
archaeological investigations that show an active regional and extra-regional
biosocial interaction.
Uno de los problemas más relevantes de la biología evolutiva humana es determinar las causas que de la diversidad morfológica observada dentro y entre poblaciones producto de un proceso evolutivo que puede ser explicado mediante la aplicación de modelos teóricos específicos derivados de la genética cuantitativa. Estos modelos hacen referencia a la acción de un factor en particular o combinaciones de dos o más factores entre los cuales se destacan aquellos que involucran a la deriva genética exclusivamente, a la acción conjunta de la deriva y la migración o solamente a la selección natural. En general, la aplicación de estos modelos se basa en una serie de consideraciones teóricas, prácticas y en supuestos cuyo cumplimiento o no permite descartar un efecto particular y aceptar otro como más probable.
Por ejemplo, la aplicación del modelo de deriva génica regulada por la acción de la migración basado en los trabajos de Relethford (1980), Relethford (1994, 1995), Relethford y Blangero (1990), Relethford y Harpending (1994, 1995), permitió estudiar la estructura biocronológica y comprender el proceso microevolutivo en las poblaciones del valle de Azapa y de los Oasis de San Pedro de Atacama en el Norte Árido de Chile (Cocilovo y Rothhammer 1996 a, 1996 b; Cocilovo y Varela 1998; Cocilovo y Rothhammer 1999; Rothhammer et al. 1982, 1984; Varela y Cocilovo 2000, 2002).
Siguiendo esta línea de investigación, pero contando con un registro mucho más amplio sobre poblaciones antiguas del Área Andina Centro Meridional (Sur de Bolivia, Norte de Chile y Noroeste Argentino), nuevamente la aplicación del modelo deriva-migración permitió comprobar una marcada divergencia fenotípica (FST = 0.19), posiblemente producida por la dispersión de varias líneas a partir de una población ancestral común (Cocilovo et al. 2009; Varela et al. 2008).
Sin embargo, otras evidencias apuntan a la selección natural como factor influyente en la divergencia de las poblaciones actuales y antiguas. Por ejemplo, Roseman (2004), empleando muestras de una amplia distribución mundial y basándose sólo en la asociación entre morfología y el clima, sugirió el efecto de la selección natural sobre la diferenciación del cráneo, mientras que otros estudios no proporcionaron pruebas fehacientes acerca de esta relación. En efecto, Relethford (2004) y Betti et al. ( 2009, 2010), prueban que el aislamiento por distancia y la deriva génica habrían jugado un rol relevante en los proceso de variación craneométrica entre las poblaciones. Por otra parte, Pérez y Monteiro (2009), analizando una serie de muestras craneanas de Argentina y Chile, comprueban que la divergencia morfológica es demasiado alta como para ser explicada sólo por deriva genética, razón por la cual sugieren la acción de la selección natural y de la plasticidad fenotípica.
De acuerdo a lo expuesto, se pone de manifiesto la existencia de criterios y experiencias que originan pruebas divergentes para explicar la diferenciación de las poblaciones humanas, al emplear modelos rivales de uno, dos o tres factores evolutivos. Sin negar la importancia de un factor particular en una situación dada, es necesario advertir que la capacidad de generalización de un modelo para explicar la realidad en casos y oportunidades distintas, depende del control de los supuestos que sustentan los resultados obtenidos.
Cuando el tiempo de separación entre las
poblaciones no es muy grande, es decir en procesos microevolutivos, como el
ocurrido con las poblaciones del Área Andina Centro Meridional, se asume que la mutación tiene un efecto
mínimo sobre la matriz de varianza covarianza genética, y que la heredabilidad
es constante (Lande 1976; Spicer 1993; Turrelli et al. 1988).
La divergencia fenotípica puede ocurrir como
consecuencia del apareamiento no aleatorio, la deriva génica y la selección natural.
Estos factores producirán una disminución de la varianza genética dentro de grupos
y un aumento de la varianza entre grupos, el primero de ellos como consecuencia
del apareamiento entre individuos emparentados, el segundo por las
fluctuaciones al azar de las frecuencias génicas en poblaciones de tamaño pequeño
y el tercero al favorecer la reproducción de algunos fenotipos (genotipos) mejor
adaptados que otros en determinados ambientes con distinta disponibilidad de
recursos y condiciones de habitabilidad. Dentro de una determinada región el
aumento de la heterocigosidad local puede ser compensado por el efecto de la
migración.
El modelo de divergencia neutral o hipótesis neutralista propuesta por Lande (1976, 1977) permite poner a prueba si la diferencia entre grupos puede ser explicada sólo por la acción de la deriva genética, supone apareamiento aleatorio dentro de grupos y ausencia de mutación, migración y selección natural. El rechazo de esta hipótesis sugiere que otras fuerzas como la selección o la migración pueden haber influido en el proceso de divergencia fenotípica (Lynch 1989).
Otro modelo es el que propone la divergencia entre poblaciones a partir del equilibrio entre deriva génica y migración (Relethford y Blangero, 1990). Se supone que los caracteres cuantitativos son selectivamente neutros, que la tasa de mutación es similar en todas las poblaciones, la migración es constante y el número de migrantes es igual entre cualquier par de poblaciones. Las desviaciones con respecto al mismo, pueden ser explicadas por variación en el tamaño efectivo o por diferencias en la tasa de flujo génico proveniente de localidades próximas o desde otras regiones.
Si bien, hasta el momento se consideró que el proceso
evolutivo de los grupos que poblaron y colonizaron el Área Andina Centro
Meridional, fue explicado principalmente por la acción de la deriva genética balanceada
por la migración (Cocilovo et al. 2009; Varela et al. 2008), no puede ser descartada la posibilidad de
que además, pueda haber actuado la selección natural, pensando en los
resultados obtenidos por Pérez y Monteiro (2009). Por este motivo, el propósito del presente trabajo es evaluar si la
divergencia fenotípica observada entre los grupos antiguos del área citada
puede ser explicada exclusivamente por la deriva genética, por la deriva y la
migración o por la selección natural.
Materiales y Métodos
Los materiales de Cochabamba
(Bolivia) están
depositados en el Museo Arqueológico en Cochabamba y
pertenecen a los períodos Formativo, Tiwanaku e Histórico, con un rango
cronológico entre el 0 y 1700 DC (O’ Brien 2003).
Las muestras del Norte de Chile (Arica, Caleta Huelén 42, San Pedro de
Atacama, Punta Teatinos y El Cerrito) están alojadas en
diferentes instituciones de Chile (Museo Nacional de Historia Natural en Santiago, Museo de Arqueología San
Miguel de Azapa en Arica e Instituto de Investigaciones Arqueológicas R.P.
Gustavo Le Paige, S.J. en San Pedro de Atacama). Estas colecciones abarcan un importante intervalo temporal, desde 5000 AC hasta 1475 DC
y se corresponden con los periodos Arcaico Tardío, Formativo, Tiwanaku e
Intermedio Tardío (Allison et al. 1984; Berenguer y
Dauelsberg 1989; Berenguer et al. 1986; Espoueys et al., manuscrito no publicado; Focacci y Chacón 1989; Focacci
1974; Hidalgo y Focacci 1986; Kuzmanic y Castillo 1986; Muñoz 1989; Núñez
et al. 1975; Quevedo 1998; Rivera
1987, 1991; Schiappacasse y
Niemeyer 1968; Schiappacasse et al. 1989; Standen 1991; Tarragó 1989; Vera
1981; Zlatar 1983; Quevedo et al. 2000, 2003).
Por último, las muestras provenientes de los sitios del Noroeste Argentino (Puna Jujeña y Selvas Occidentales) están depositadas en el Museo Etnográfico "Juan Bautista Ambrosetti" de la Universidad Nacional de Buenos Aires y en el Museo de Ciencias Naturales de La Plata, han sido asignadas a los períodos Temprano, Medio y Tardío de la región, con fechas entre el 600 y el 1480 DC (Baffi y Cocilovo 1989; Baffi et al. 1996; Mendonça et al. 1991). Para un mayor detalle de los períodos y fases culturales de la muestra remitirse a Cocilovo et al. (2005, 2009) y Varela et al. (2008).
Se empleó una muestra constituida
por 455 individuos adultos no deformados artificialmente (225 masculinos y 230
femeninos) provenientes del Sur de Bolivia, del Noroeste de Argentina y del
Norte Árido y Semiárido de Chile (tabla 1, figura 1). La matriz de datos fue
integrada con 15 caracteres métricos del cráneo: longitud máxima, anchura
máximao, altura basilo bregmática, diámetro frontal mínimo, diámetro frontal
máximo, anchura fronto malar, altura nasio alveolar, anchura bicigomática, altura
de la nariz, anchura de la nariz, altura de la orbita, anchura de la orbita, anchura
biorbitaria, diámetro alveolo basilar y diámetro nasion basion. Se eliminó la
variabilidad debida al sexo mediante la aplicación del Modelo Lineal General (Seber
1984).
Para evaluar cuales fueron los
factores evolutivos involucrados en la divergencia de las poblaciones, se asume
un modelo de herencia aditiva, es decir que los caracteres métricos del cráneo
están determinados por un conjunto de genes que contribuyen por igual y en
forma aditiva (no hay interacción dentro locus y entre loci) (Falconer y
Mackay, 1996). A continuación se presentan las hipótesis que se pusieron a
prueba.
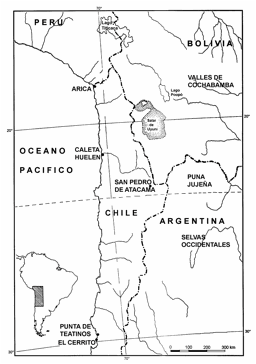
Figura 1. Área Andina Centro Sur:
ubicación de las muestras estudiadas.
Figure 1. South Central Andean Area: Location of the studied samples.
|
Región
(Código) |
Subregión
(Código) |
Cronología |
N |
|
Sur de
Bolivia (SB) |
Cochabamba
(CCBB) |
0-1700 DC |
162 |
|
Noroeste
de Argentina (NOA) |
Puna
Jujeña (PUNA) |
1000
DC-1480 DC |
95 |
|
|
Selvas
Occidentales (SELV) |
600 DC-700
DC |
14 |
|
Norte de
Chile (NCH) |
Arica
(ARICA) |
3000
AC-1470 DC |
49 |
|
|
Caleta
Huelén 42 (CAHU) |
2830
AC-1830 AC |
22 |
|
|
San Pedro
de Atacama (SPA) |
300
AC-1480 DC |
51 |
|
|
Punta
Teatinos (TEAT) |
2955
AC-2050 AC |
43 |
|
|
El
Cerrito (CERR) |
1830 AC |
19 |
|
Total |
|
|
455 |
Tabla
1. Nombre y tamaño de las
muestras del área Andino Centro Meridional empleadas en este estudio.
Table 1. Name and size of the samples of South Central
Andean area used in this study.
Hipótesis de divergencia neutral
En este caso el proceso de
divergencia ocurre sólo por la acción de la deriva genética, entonces se supone
que las líneas o subpoblaciones del área de estudio se originaron a partir de
una misma población ancestral, que cada una de ellas tienen un tamaño
poblacional efectivo (Ne) pequeño y constante, apareamiento
aleatorio dentro de línea, y ausencia de mutación, flujo génico y selección
natural (Falconer y Mackay 1996).
En un modelo exclusivo de deriva,
la varianza genética dentro (Vw) y entre grupos (VbE)
esperada de un carácter de herencia aditiva es:
Vw=V0 (1-F)
y VbE=V02F,
donde V0 es la varianza en la población panmíctica inicial y F el coeficiente de endogamia en el tiempo t (Crow y Kimura 1970; Wright 1952). La varianza entre grupos VbE alcanza distintos valores en el intervalo 0 ≤ F ≤ 1 siendo máxima cuando F=1.
Varianza entre grupos máxima
Se estimó el valor máximo esperado promedio para todas las variables de VbE cuando F=1, siendo Vw la media de la suma de cuadrado dentro de grupos. Además, para conocer V0=Vw/(1-F) se calculó el valor de divergencia genética (F) entre las ocho poblaciones de la región mediante el método Relethford y Blangero (1990), el cual se detalla más adelante. Si los resultados indican que el valor observado de Vbo, (calculado como el promedio para todas las variables de la suma de cuadrado entre grupos) es mayor al valor esperado V02F, cuando F es igual a uno, es posible sospechar la acción de otros factores evolutivos que aporten nueva variabilidad genética al sistema como la mutación o la migración.
En un proceso dispersivo después de t generaciones, F = (1-(1-1/2Ne)t), se espera que en el tiempo la media no cambie y que en el caso univariado: VbE = Vw h2 t/Ne y en el caso multivariado: VbE = (t/Ne)G, siendo h2 la heredabilidad del carácter o su valor medio para un conjunto de caracteres, G la matriz genética aditiva y Ne el tamaño reproductor efectivo (Lande 1976, 1977, 1979; Lofsvold 1988). En general se ha observado que la matriz de varianza-covarianza fenotípica dentro de grupos (W) es proporcional a G (Cheverud 1988; Roff 1995, 1996). La hipótesis de divergencia neutral se puede poner a prueba mediante los métodos de Lande (1977) y Ackermann y Cheverud (2002, 2004).
Método de Lande (caso univariado)
Lande
(1977), sugiere que la
hipótesis de neutralidad selectiva se puede probar mediante el estadístico L (en
el presente trabajo se remplaza la letra original F por L para diferenciarlo
del coeficiente de endogamia),
L=Vb/(Vw h2 t/Ne) (1)
L se distribuye como una F con n-1 grados de libertad en el
numerador (n es el numero de grupos o poblaciones) e infinitos grados de
libertad en el denominador. Como se mencionó antes, Vb representa la
varianza fenotípica entre poblaciones para el carácter z en la
generación t. Las varianzas dentro (Vw) y entre (Vb)
poblaciones se calcularon como el promedio de la suma de cuadrado dentro y
entre grupos respectivamente, obtenidas mediante un ANOVA para cada uno de los
15 caracteres.
Se consideró el valor h2
promedio igual a 0.8 para las variables del cráneo porque representa una estimación
máxima sugerida para poblaciones prehistóricas del norte del Chile y el NO de
Argentina (Varela y Cocilovo 1999; Varela y Cocilovo 2002, 2007; Cocilovo et
al. 2006; Medeot et al. 2008); además se utilizó el valor más generalizado de h2=0.55
para facilitar la comparación con otros trabajos que aplican modelos de
genética cuantitativa empleando variables métricas del cráneo.
Se asumió un tiempo de divergencia (t) de 10000 años, considerando los fechados en Chile de 11000 A.P. para la Puna (Nuñez y Santoro 1988) y 9000 A.P. para el sitio Acha 2 (Muñoz y Chacama 1993). Se consideró un intervalo generacional medio de 28 años, de acuerdo a lo sugerido por Fenner (2005), lo cual significa que el proceso evolutivo abarca aproximadamente 357 generaciones (10000/28).
Por
último, de acuerdo con la
ecuación (1), se calculó el Ne mínimo necesario para rechazar la
hipótesis nula que establece que la divergencia ocurrió exclusivamente por la
acción de la deriva genética.
Método de Akermann y Cheverud (Caso multivariado)
La hipótesis de divergencia por deriva genética también puede probarse de acuerdo a la siguiente propuesta:
B α (t/Ne)W (2)
Si la diversificación de los grupos ocurrió por deriva genética y como t
y Ne son constantes, se espera que exista proporcionalidad entre las
matrices de dispersión fenotípica entre grupos (B) y dentro grupos (W), es
decir B α W. La ecuación (2) arriba
expuesta puede expresarse como una regresión lineal,
ln(Bi)
= ln(t/Ne) + β ln(Wi),
donde Bi son los autovalores del i-ésimo autovector de la matriz de varianza covarianza entre grupos y Wi son los autovalores de la matriz de varianza covarianza dentro de grupos. Los cálculos de los autovalores de las dos matrices se obtuvieron mediante el programa InfoStat (Di Rienzo et al. 2011). Si la diferenciación entre las poblaciones ocurrió por deriva genética se espera que la pendiente de la recta (β) sea igual a 1. Como la regresión prueba si β=0 y es necesario probar si β=1, para estimar el estadístico t de Student se calculó la diferencia 1- β. Si este coeficiente es estadísticamente diferente de 1 se supone que otros factores no aleatorios (selección y migración) habrían actuado en la divergencia entre los grupos.
Hipótesis del equilibrio entre deriva
génica y migración.
También se analizó la divergencia
morfológica entre las poblaciones mediante la aplicación del modelo
desarrollado para caracteres cuantitativos que establece un equilibrio entre
deriva genética y migración.
Método de Relethford y Blangero
Predice una relación lineal entre
la varianza fenotípica promedio dentro de grupos (VPw) y la distancia genética
de cada grupo con respecto a la media de la población total (rii),
E(VPi) = VPw(1- rii)/(1-F)
donde VPi es la varianza fenotípica media esperada de la población i y F la distancia genética promedio o la endogamia media dentro de grupos, que se calcula como el promedio de las distancias rii . Este modelo asume que los caracteres métricos son selectivamente neutros, la tasa de mutación es semejante en todas las poblaciones, la migración es constante y similar el número de migrantes entre cualquier par de poblaciones. Las desviaciones con respecto a este modelo se pueden explicar por variaciones en el tamaño efectivo o por diferencias en la tasa de flujo génico desde otra región. Si un grupo recibe un flujo génico mayor que el flujo génico promedio tendrá una varianza observada mayor que la esperada, y si el flujo génico es reducido tendrá una varianza observada menor (Relethford 1994; Relethford 1996; Relethford y Blangero 1990; Relethford y Harpending 1994; Relethford et al. 1997). Para estimar los diferentes estadísticos (VPi, VPw, rii, F) se empleó el programa Rmet versión 5.0 (http://konig.la.utk.edu/relethsoft.html).
Resultados
Hipótesis de divergencia neutral
Varianza
entre grupos máxima
Aplicando el método de Relethford y Blangero (1990), el valor F de divergencia genética o endogamia promedio dentro de grupos estimado para las ocho poblaciones es 0.21, empleando una heredabilidad de 0.55. La varianza dentro de grupos (Vw) promedio para todas las variables obtenida mediante análisis de la varianza es 16.4 (tabla 2), y la varianza inicial (V0=Vw/(1-F)) es 20.76. Con esta información, en un proceso dispersivo, el valor máximo de la varianza esperada entre grupos (Vb=V02F) es 41.52 (cuando F=1). Como se explica más adelante, este es un valor mucho menor que el valor estimado de la varianza entre grupos (Tabla 2).
|
|
Varianza |
Ne |
|
|
|
|
h2 = .8 |
h2 = .55 |
|
Entre (Vb) |
174.061 |
|
|
|
|
|
54 |
37 |
|
Dentro (Vw) |
16.437 |
|
|
Tabla 2.Tamaño efectivo mínimo para rechazar la hipótesis de
divergencia sólo por deriva genética.
Table 2. Minimum effective
size to reject the hypothesis of divergence by genetic drift alone.
Método de Lande
Los resultados derivados del método de Lande (1976, 1977) para las dos heredabilidades empleadas (0.8 y 0.55) se presentan en la tabla 2. En ella se observa, en promedio para todos los caracteres, las varianzas dentro y entre grupos, y los valores Ne mínimos a partir de los cuales se rechaza la hipótesis nula de neutralidad selectiva a un nivel de significación del 5%. Este Ne mínimo se obtiene cuando el estadístico L (ecuación 1) es igual a dos, con siete grados de libertad en el numerador e infinitos en el denominador. Para aceptar la hipótesis planteada sería necesario en promedio un tamaño poblacional efectivo pequeño, es decir menor a 54, si h2 es 0.8 o menor a 37 si h2 es 0.55, si estos valores fuesen mayores habría que sospechar el efecto de la selección natural y de la migración.
Método de Akermann y Cheverud
Los
resultados de la aplicación de este método se observan en la figura 2, en ella se
presenta la regresión del logaritmo natural de los autovalores de la matriz de varianza covarianza entre grupos sobre los de la matriz de
varianza covarianza dentro de grupos. Puesto que la pendiente de la recta es diferente de 1 (R2 = 0.912, β = 1.992,
1-β = 0.992, t = 3.583, p = 0.0158) el proceso microevolutivo no
ocurrió exclusivamente por deriva génica sino también por la acción de la
selección natural.
Equilibrio entre deriva génica y
migración.
Método de Relethford y Blangero
En la tabla 3 se observan los resultados derivados de este modelo, y en la figura 3 se presenta la relación entre la varianza fenotípica dentro de grupos y la distancia genética de cada grupo con respecto al promedio de la población total (rii). Al comparar las varianzas observadas y esperadas, las muestras de PUNA y SELV presentan un exceso de varianza dentro de grupos indicando, la acción de un mayor flujo génico extrarregional, mientras que en CAHU la menor varianza dentro de grupos indicaría su desarrollo en condiciones de mayor aislamiento reproductivo.
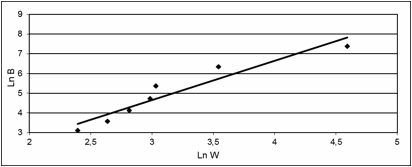
Figura 2. Método de Akermann y Cheverud: regresión lineal del logaritmo de los autovalores de la matriz de
varianza covarianza entre grupos (Ln B) sobre logaritmo de los autovalores de
la matriz de varianza covarianza dentro de grupos (Ln W).
Figure 2. Akermann and Cheverud method: linear regression of the eigenvalues of
the covariance matrix between group (Ln B) on the logarithm of the eigenvalues
of the covariance matrix within group (Ln W).
|
|
|
Varianza dentro de grupos |
|
|
Población |
rii |
Observada |
Esperada |
|
CCBB |
.098 |
.968 |
.910 |
|
PUNA |
.251 |
1.022 |
.755 |
|
SELV |
.480 |
.657 |
.524 |
|
ARICA |
.042 |
.938 |
.966 |
|
CAHU |
.167 |
.626 |
.839 |
|
SPA |
.173 |
.739 |
.833 |
|
TEAT |
.289 |
.667 |
.717 |
|
CERR |
.195 |
.738 |
.811 |
Tabla
3. Distancia a la media
poblacional (rii) y varianza fenotípica dentro de grupo
Table
3. Distance to the
population mean (rii) and within-group phenotypic variance
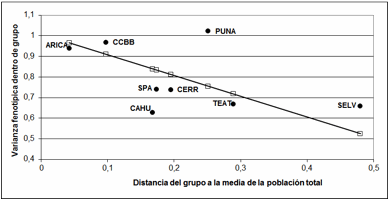
Figura 3. Método de Relethford y Blangero: relación entre la
varianza fenotípica dentro de grupos (Vw) y la distancia genética de
cada grupo con respecto al promedio de la población total (rii).
Figure 3. Relethford and Blangero method: relationship among group-within
phenotypic variance (Vw) and genetic
distance of each group from the total population average (rii).
Discusión
Hipótesis de divergencia neutral
Varianza
entre grupos máxima
Los resultados muestran que la
varianza entre poblaciones observada para el área Andina Centro Sur (Vb
= 174, tabla 2) es 4.2 veces superior a la máxima esperada en un proceso de
divergencia por deriva genética (Vb=41.5) cuando la endogamia es
igual a 1. Esto estaría indicando, si se acepta un escaso o nulo efecto de la
mutación, la introducción de nueva variabilidad genética en el área de estudio
como consecuencia de la migración.
Método de Lande
La hipótesis establece que la
divergencia morfológica ocurrió sólo por deriva genética. En este caso seria
necesario, en 357 generaciones, un tamaño poblacional efectivo pequeño, menor o
igual a 37 o 54 individuos como término medio, dependiendo si h2 es 0.55
o 0.8 respectivamente. Estos valores son mucho menores que los estimados para
las poblaciones prehistóricas de Arica y San Pedro de Atacama, entre 900 y 1000
(Cocilovo y Varela 1998; Varela y Cocilovo 2000), razón por la cual es posible
rechazar la hipótesis de neutralidad selectiva propuesta (según Lande 1976),
pues la varianza observada entre poblaciones es mayor a la esperada por un
modelo exclusivo de deriva genética. En este caso se espera la posible acción
de la selección natural, sin embargo no puede ser descartada la influencia de
la migración con una tasa diferencial entre poblaciones.
Método de Akermann y Cheverud
Los resultados derivados de este
modelo indican que la variación fenotípica entre grupos no
es proporcional a la variación fenotípica dentro de grupos. La pendiente (β) de la recta es estadísticamente mayor
que 1, sugiriendo nuevamente que la deriva genética no sería el único factor
responsable de la divergencia entre las poblaciones.
De acuerdo a lo expuesto hasta aquí los resultados de la aplicación de los distintos métodos indican un exceso de variación de acuerdo a lo esperado sólo por la deriva genética y la posible acción tanto de la selección natural como de la migración.
Equilibrio entre deriva génica y
migración
Método de Relethford y Blangero
Suponiendo que los caracteres
métricos del cráneo son selectivamente neutros, la dispersión de las
poblaciones, por encima y por debajo de la recta que marca las condiciones de
equilibrio entre la deriva y la migración (Fig. 3), permite inferir la magnitud
y dirección de uno u otro efecto microevolutivo. En tal sentido la ubicación de
las poblaciones de Puna y Selvas Occidentales refleja la existencia de una
varianza dentro de grupos mayor que la esperada. Este incremento de la
variabilidad es consecuencia de un exceso de flujo génico de amplio rango desde
otra región externa al área de estudio.
Por otra parte, la posición del
grupo arcaico de Caleta Huelén 42 debajo de la recta de equilibrio (Fig. 3),
puede ser el resultado de un mayor aislamiento y del apareamiento no aleatorio.
En el caso de San Pedro de Atacama, El Cerrito y Punta de Teatinos la varianza
observada es menor que la esperada, lo cual puede explicarse por las mismas
causas o tal vez, por un importante efecto migratorio local.
Los
antecedentes arqueológicos indican que el Área Andina Centro Meridional recibió
influencias en diferentes momentos y de magnitud variable desde el sur de Perú,
el altiplano boliviano y la floresta tropical (Berenguer y Dauelsberg 1989; Coll 2009; González y Pérez 1966; González y Pérez 1972; Muñoz 1989; Núñez y Dillehay 1995; Pereira
et al. 2000; O’ Brien 2003;
Rivera 1991; Schiappacasse et al. 1989), evidencias que avalan la importancia de la migración como principal factor evolutivo que explica del exceso de variabilidad
morfológica observada en el área de estudio.
Si bien la divergencia
morfológica comprobada en las poblaciones analizadas puede haber sido el
resultado de varios factores evolutivos por las evidencia derivadas de este
trabajo y de los antecedentes arqueológicos existentes, la deriva y la
migración parecen ser las fuerzas principales que operaron en el pasado. Tal
vez, en el futuro habría que considerar la aplicación de un modelo que
contemple la acción conjunta de los factores anteriores y de la selección
natural.
Pérez y Monteiro (2009) expresan que la divergencia craneofacial entre poblaciones humanas de Argentina y Chile es demasiado alta para ser explicada solo por deriva genética y que parte de ella puede ser consecuencia de la acción de la selección natural o de la plasticidad fenotípica, pero en este trabajo no se consideró la influencia del flujo génico como factor fundamental en el aporte de novedades genéticas. La selección natural no genera nueva variabilidad genética sino que la redistribuye entre localidades, disminuyendo la variación local. Por ejemplo, la distribución de los grupos Cochabamba, Puna y Selvas Occidentales en la figura 3, no podría ser explicada por la acción de la selección natural pues poseen una varianza dentro de grupo mayor que la esperada por un equilibrio entre la deriva y la migración (Tabla 3). Sin embargo, el caso de Caleta Huelén 42 por presentar una varianza observada 25 % menor que la esperada, podría admitir una explicación relacionada con el efecto de la selección natural, aunque no puede ser descartado un efecto fundador (Cocilovo et al. 2005).
La distribución de los grupos que se observa en la figura 3, coincide bien con la explicación brindada en Varela et al (2008) sobre la evolución en el Área Andina Centro Meridional, basada en la divergencia genética de las poblaciones producida por el aislamiento espacial. En este proceso, la cordillera andina jugó un rol importante como barrera geográfica restringiendo pero no limitando totalmente el flujo génico y la interacción entre los habitantes de ambas vertientes de los Andes.
Es importante señalar que los
modelos derivados de la genética cuantitativa aplicados en experiencias como la
presente, tienen como principal interés explicar en forma más sencilla los
fenómenos evolutivos ocurridos en las poblaciones naturales. Sin embargo, es
inevitable observar que algunos de ellos ponen a prueba la intervención exclusiva
de un factor evolutivo como por ejemplo la deriva genética, y sugieren hacer inferencias
indirectas sobre la importancia de las otras fuerzas evolutivas intervinientes.
Otros modelos, permiten evaluar la intervención de dos fuerzas evolutivas
opuestas como la deriva génica y la migración haciendo el supuesto de ausencia
de selección natural, originando explicaciones diferentes. Frente a esta
situación, sería ideal la aplicación de modelos que permitan cotejar y poner a
prueba el efecto conjunto de más de dos factores evolutivos, y además lograr
mayor precisión en los parámetros empleados como la proporción de la varianza
genética y ambiental de los caracteres cuantitativos, el tiempo de divergencia
de los grupos y el tamaño efectivo de las poblaciones estudiadas. Avanzar en
esta dirección permitirá lograr una explicación más realista del proceso
evolutivo experimentado por las poblaciones humanas prehistóricas que habitaron
América del Sur.
Agradecimientos. Agradecemos
la colaboración brindada por las autoridades y el personal de los museos en
donde se encuentran depositadas las colecciones osteológicas empleadas en este
trabajo: Museo Arqueológico en Cochabamba, Museo Nacional de Historia Natural en
Santiago, Museo de Arqueología San Miguel de Azapa en Arica, Instituto de
Investigaciones Arqueológicas R.P. Gustavo Le Paige, S.J. en San Pedro de
Atacama, Museo Etnográfico "Juan Bautista Ambrosetti"
de la Universidad Nacional de Buenos Aires y Museo de
Ciencias Naturales de La Plata. El presente trabajo se realizó
con los siguiente fondos: Consejo
Nacional de Investigaciones Científicas y Técnicas (CONICET, PIP 2405/08),
Argentina; Secretaría de Ciencia y Técnica-Universidad Nacional de Río Cuarto
(SeCyT-UNRC), Argentina; Ministerio
de Ciencia y Técnica de la Provincia de Córdoba, Argentina (Res:1276/07) y
Agencia Nacional de Promoción Científica y Técnica (ANPCYT-FONCYT PICT 02210/07),
Argentina.
Bibliografía
Ackermann,
R.R. y Cheverud, J.M., 2002, Discerning evolutionary processes in patterns of
Tamarin (Genus Saguinus) craniofacial variation. American Journal of Physical
Anthropology, 117, 260-271.
Ackermann,
R.R. y Cheverud J.M., 2004, Detecting genetic drift versus selection in human
evolution. Proceedings of the National
Academy of Sciences of the USA 101, 17946-17951.
Allison, M.,
Focacci G., Arriaza B., Standen V., Rivera M., y Lowenstein J., 1984,
Chinchorro. Momias de preparación complicada: métodos de
momificación. Chungara,
13, 155-174.
Arriaza,
B., 1995, Beyond death: the Chinchorro mummies of ancient Chile, (Washington:
Smithsonian Institution Press). pp.176.
Baffi, E.I. y Cocilovo J.A., 1989, Evaluación del impacto ambiental en una población prehistórica: el caso de Las Pirguas (Salta, Argentina). Revista de Antropología, 4, 39-43.
Baffi, E.I., Torres M.F. y Cocilovo J.A., 1996, La población prehispánica de Las Pirguas (Salta, Argentina). Un enfoque integral. Revista Argentina de Antropología Biológica, 1, 204-218.
Berenguer, J. y Dauelsberg P., 1989, El Norte Grande en la órbita de Tiwanaku (400 a 1.200 d.C.). Culturas de Chile. Prehistoria. Desde sus orígenes hasta los albores de la conquista, editado por J. Hidalgo, V. Schiappacasse, H. Niemeyer, C. Aldunate y I. Solimano (Santiago, Chile: Editorial Andrés Bello), pp 129-180.
Berenguer, J., Deza, A., Román, A., y Llagostera,
A., 1986, La secuencia de Myriam Tarragó para San Pedro de Atacama: Un test por
termoluminiscencia. Revista
Chilena de Antropología, 5, 17-54.
Betti, L.,
Balloux, F., Amos, W., Hanihara, T., y Manica, A., 2009, Distance from Africa,
not climate, explains within-population phenotypic diversity in humans. Proceedings
of the Royal Society B, 276, 809-814.
Betti, L.,
Balloux, F., Hanihara, T. y Manica, A., 2010, The Relative Role of Drift and
Selection in Shaping the Human Skull. American Journal of Physical Anthropology,
141,76-82
Cheverud, J. M., 1988, A comparison of genetic and phenotypic correlations. Evolution, 42, 958-968.
Cocilovo,
J.A. y Rothhammer, F., 1996
a, El Valle de Azapa en el Norte de Chile. Análisis de un
modelo biocronológico para establecer la estructura de la población. Revista Argentina de Antropología
Biológica, 1, 232-245.
Cocilovo,
J.A. y Rothhammer, F., 1996 b, Methodological approaches for the solution of
ethnohistorical problems: bioassay of kinship in prehistoric populations of
Arica, Chile. Homo, 47,177-190.
Cocilovo, J.A. y Rothhammer, F., 1999, Microevolución morfológica y extinción del parentesco en asentamientos humanos prehistóricos del Valle de Azapa, Chile. Revista Chilena de Historia Natural, 72, 213-218.
Cocilovo, J.A. y Varela, H.H., 1998, Variación morfológica, estructura canónica y bioensayo de parentesco en poblaciones prehistóricas del norte de Chile. Chungara, 30, 75-85.
Cocilovo, J.A.,
Varela, H.H. y O’Brien, T.G., 2009, La divergencia genética entre poblaciones del
Area Andina Centro Meridional evaluada mediante rasgos no métricos del cráneo. Revista Argentina de Antropología
Biológica, 11, 43-59.
Cocilovo,
J.A., Varela, H.H.
y Quevedo, S., 2006, La Asimetría bilateral y la inestabilidad del desarrollo.
Un caso de aplicación en restos óseos humanos del sitio Punta de Teatinos
(Norte de Chile). Revista Argentina de
Antropología Biológica, 8,121-144.
Cocilovo, J.A., Varela, H.H., Costa-Junqueira, M.A. y Quevedo S, 2005, Los pescadores arcaicos de la desembocadura del río Loa (Norte de Chile): el sitio Caleta Huelén 42. Chungara, 37,5-19.
Coll, V., 2009, Medio ambiente, espacio y
paisaje en el Noroeste Argentino: una mirada a través de la historia. Comechingonia Virtual. 2:154-174.
Crow, J.F.,
y Kimura M., 1970, An introduction to population genetics theory (New York: Harper y Row). pp. 591.
Di Rienzo, J.A., Casanoves, F., Balzarini, M.G., Gonzalez, L., Tablada, M. y Robledo, C.W., InfoStat ver. 2011, Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. URL http://www.infostat.com.ar.
Espoueys O., Uribe, M., Roman, A. y Deza, A.,
(Manuscript). Nuevos fechados por termoluminiscencia para la cerámica del Período
Medio del Valle de Azapa (primera parte). FONDECYT 193-0202. Santiago, Chile.
Falconer, D.S. y Mackay, T.F.C., 1996, Introduction to Quantitative Genetics.
(England: Longman Group Ltd). pp. 464.
Fenner, J.N.,
2005, Cross-Cultural Estimation of the Human Generation Interval for Use in
Genetics-Based Population Divergence
Studies. American
Journal of Physical Anthropology, 128, 415-423.
Focacci,
G. 1974. Excavaciones en el cementerio Playa Miller 7, Arica. Chungara, 3, 23-74.
Focacci, G. y Chacón, S., 1989, Excavaciones arqueológicas en los faldeos del Morro de Arica, sitios 1/6 y 2/2. Chungara, 22, 15-62.
González, A.R. y Pérez, J.A., 1966, El Área Andina Meridional. En Actas y Memorias del XXXVI Congreso Internacional de Americanistas. Sevilla. I, 241-265.
González, A.R. y Pérez, J.A., 1972,
Argentina Indígena: Vísperas de la conquista (Buenos Aires. Ed. Paidos). pp. 177.
Hidalgo, J. y Focacci, G., 1986, Multietnicidad en Arica. S.XVI. Evidencias etnohistóricas y arqueológicas. Chungara, 16-17,137-147.
Kuzmanic,
I. y Castillo, G., 1986, Estadio
arcaico en la costa del norte semiárido de Chile. X Congreso Nacional de
Arqueología Chilena. Chungara,
16-17, 89-94.
Lande, R.,
1976, Natural selection and random genetic drift in phenotypic evolution. Evolution,
30, 314-334.
Lande, R.,
1977, Statistical tests for natural selection on quantitative characters.
Evolution 31, 442-444.
Lande, R., 1979, Quantitative genetic analysis of multivariate evolution, applied to brain:body size allometry. Evolution, 33, 402-416.
Llagostera
A., 1989, Caza y Pesca Marítima (9.000 a 1.000 a.C.). Culturas de Chile.
Prehistoria. Desde sus orígenes hasta los albores de la conquista, editado por
J. Hidalgo, V. Schiappacasse, H. Niemeyer, C. Aldunate y I. Solimano (Santiago,
Chile: Editorial Andrés Bello) pp. 57-79.
Lofsvold,
D., 1988, Quantitative genetics of morphological differentiation in Peromyscus.
II. Analysis of selection and drift. Evolution, 42, 54-67.
Lynch, M.,
1989, Phylogenetic hypotheses under the assumption of neutral quantitative-
genetic variation. Evolution,
43,1-17.
Medeot, E.,
Cocilovo, J.A. y Varela, H.H., 2008, Varianza ambiental y estabilidad del
desarrollo en la población prehispánica de Las Pirguas (Salta, Argentina). Latin
American Antiquity, 19,146-157.
Mendonça,
O.J., Cocilovo, J.A. y Valdano, S.G., 1991, La población prehistórica de la
cuenca de Miraflores-Guayatayo-Salinas Grandes en el sector oriental de la Puna
Jujeña. Avance en Arqueología, 1, 59-80.
Muñoz, I.,
1989, El Período Formativo en el Norte Grande. Culturas de Chile. Prehistoria.
Desde sus orígenes hasta los albores de la conquista, editado por J. Hidalgo,
V. Schiappacasse, H. Niemeyer, C. Aldunate y I. Solimano (Santiago, Chile:
Editorial Andrés Bello). pp. 107-128.
Muñoz, I.,
y Chacama, J., 1993, Patrón de Asentamiento y Cronología de Acha-2. Acha - 2 y los Orígenes del Poblamiento Humano
en Arica, editado por I. Muñoz, B.
Arriaza, A. Aufderheide (Arica: Ediciones Universidad de Tarapacá). pp. 21-46.
Nuñez, L. y
Dillehay, T., 1995, Movilidad Giratoria, Armonía Social y Desarrollo en los
Andes Meridionales: Patrones de Tráfico e Interacción Económica (Antofagasta Universidad
Católica del Norte).
Nuñez, L. y
Santoro, C., 1988, Cazadores de la puna
seca y salada del área centro-sur Andina (Norte de Chile). Estudios Atacameños,
9, 11-60.
Núñez, L.,
Zlatar, V. y Núñez, P., 1975, Caleta Huelén 42: Una Aldea Temprana en el Norte
de Chile (Nota Preliminar). Hombre y Cultura, 67-103. Revista del Centro de Investigaciones Antropológicas. Universidad
de Panamá, Panamá.
O’Brien,
Tyler G., 2003, Cranial microvariation in prehistoric south central andean
populations: an assessment of morphology in the Cochabamba collection, Bolivia.
Ph.D. thesis, Binghamton University, State University of New York.
Pereira, D.,
Brockington, D. y Sanzetenea, R., 2000, Investigaciones Arqueológicas en las
Tierras Tropicales del Departamento de Cochabamba- Bolivia (Cochabamba: Universidad
Mayor de San Simón,). pp. 210.
Pérez, S.I. y Monteiro, L.R., 2009, Nonrandom factors in modern human morphological diversification: a
study of craniofacial variation in southern south american populations. Evolution, 63-4, 978-993
Quevedo, S., 1998, Punta de Teatinos. Biología de una población arcaica del norte semiárido Chileno. Tesis doctoral. Universidad de Buenos Aires.
Quevedo, S., Cocilovo, J.A., Varela, H.H. y Costa-Junqueira, M.A., 2003, Perfil paleodemográfico de El Cerrito (La Herradura), un grupo de pescadores arcaicos del Norte Semiárido de Chile. Boletín del Museo Nacional de Historia Natural, 52, 177-194.
Quevedo, S., Cocilovo, J.A., Costa, M.A., Varela, H.H. y Valdano, S.G., 2000, Perfil paleodemográfico de Punta de Teatinos, una población de pescadores arcaicos del norte semiárido de Chile. Boletín del Museo Nacional de Historia Natural, 49,237-256.
Relethford, J.H. 1980. Bioassay of kinship from continuous traits. Human Biology 62:5-25.
Relethford, J.H., 1994, Craniometric
variation among modern human populations. American Journal of Physical
Anthropology, 95, 53-62.
Relethford, J.H., 1995, Genetics and
modern human origins. Evolutionary Anthropology, 4, 53-63.
Relethford, J.H., 1996, Genetic
drift can obscure population history: problem and solution. Human Biology, 68, 29-44.
Relethford, J.H., 2004, Boas and
beyond: migration and craniometric variation. American Journal Human Biology,
16, 379-386.
Relethford, J.H. y Blangero, J.,
1990, Detection of differential gene flow patterns of quantitative variation.
Human Biology, 62, 5-25.
Relethford, J.H. y Harpending, H.C.,
1994, Craniometric variation, genetic theory, and modern human origins. American
Journal of Physical Anthropology, 95, 249-270.
Relethford, J.H. y Harpending, H.C.,
1995, Ancient differences in population size can mimic a recent African origin
of modern humans. Current Anthropology, 36, 667-674.
Relethford, J.H., Crawford, M.H. y Blangero,
J., 1997, Genetic drift and gene flow in Post-Famine Ireland. Human Biology, 69, 443-465.
Rivera, M., 1987, Tres fechados
radiométricos de Pampa de Alto Ramirez. Norte de Chile. Chungara 18,7-13.
Rivera, M., 1991, The prehistory of
northern Chile: a synthesis. Journal of World Prehistory, 5, 1-47.
Rivera, M., 1992, Antiguas manifestaciones de momificación humana en América: la
Tradición Chinchorro del Norte de Chile. Beiträge Zur Allgemeinen Und Vergleichenden
Archäologies, 12, 337-359.
Roff, D.A. 1995. The estimation of
genetic correlations from phenotypic correlations: a test of Cheverud’s
conjecture. Heredity 74:481-490.
Roff, D.A., 1996, The evolution of
genetic correlations: an analysis of patterns. Evolution, 50, 1392-1403.
Rothhammer,
F. Cocilovo, J.A., Quevedo, S., y Llop, E., 1982, Microevolution in prehistoric
Andean populations: I. Chronologic craniometric variation. American Journal of
Physical Anthropology, 58, 391-396.
Rothhammer,
F., Quevedo, S., Cocilovo, J. A. y Llop, E., 1984, Microevolution in
prehistoric Andean population: chronologic nonmetrical cranial variation in
northern Chile. American Journal of Physical Anthropology, 65, 157-162.
Roseman, C.C., 2004, Detecting interregionally
diversifying natural selection on modern human cranial form by using matched
molecular and morphometric data. Proceedings
of the National Academy of Sciences of the USA, 101, 12824-12829.
Schiappacasse, V. y Niemeyer H., 1968, Noticia y comentario de dos fechas radiocarbónicas para un sitio
arqueológico en Guanaqueros, Prov. de Coquimbo. Noticiario
MensuaL del Museo Nacional de Historia Natural, año XIII, 147, 36.
Schiappacasse,
V., Castro, V. y Niemeyer, H., 1989, Los desarrollos regionales en el Norte
Grande (1.000 a 1.400 d.C.). Culturas de Chile. Prehistoria. Desde sus orígenes
hasta los albores de la conquista, editado por J. Hidalgo, V. Schiappacasse, H.
Niemeyer, C. Aldunate y I. Solimano. pp. 181-220. (Santiago, Chile: Editorial Andrés
Bello).
Seber G.A.F.
1984. Multivariate observation (New York: John Wiley & Sons). 685 pp.
Spicer, G.S.,
1993, Morphological evolution of the Drosophila virilis species group as
assessed by rate tests for natural selection on quantitative characters. Evolution,
47, 1240-1254.
Standen, V., 1991, El cementerio Morro 1: nuevas evidencias de la tradición funeraria Chinchorro (Período Arcaico, norte de Chile). Tesis de Maestría, Universidad Católica de Lima, Lima.
Tarragó, M.N., 1989, Contribución al conocimiento arqueológico de las poblaciones de los oasis de San Pedro de Atacama en relación con los otros pueblos puneños, en especial, el sector septentrional del Valle Calchaquí. Tesis doctoral, Facultad de Humanidades y Artes, Universidad Nacional de Rosario, Argentina.
Turelli,
M., Gillespie, J.H. y Lande, R., 1988, Rate tests for selection on quantitative
characters during macroevolution and microevolution. Evolution, 42, 1085-1089.
Varela, H.H.
y Cocilovo, J.A., 1999, Evaluation of the Enviromental Component of the Phenotypic
Variance in Prehistoric Populations.
Homo, 50, 46-53.
Varela,
H.H. y Cocilovo, J.A., 2000, Structure of the prehistoric population of San
Pedro de Atacama. Current Anthropology, 41, 125-131.
Varela,
H.H. y Cocilovo, J.A., 2002, Genetic drift and gene flow in a prehistoric
population of the Azapa Valley and Coast, Chile. American Journal of Physical
Anthropology, 118, 259-267.
Varela,
H.H. y Cocilovo, J.A., 2007, Phenotypic, maximum genetic, and special
environmental variability in prehistoric human populations. American Journal of
Physical Anthropology, 132, 17-24
Varela, H.H.,
O’Brien, T.G. y Cocilovo, J.A., 2008, The genetic divergence of prehistoric
populations of the South-central Andes as established by means of craniometric
traits American Journal of Physical Anthropology, 137:274-282.
Vera, J., 1981, Momias Chinchorro de preparación complicada del Museo de Historia Natural de Valparaíso: 3290 y 3060 a.C. Anales del Museo de Historia Natural de Valparaíso, 14, 5-17.
Wright, S., 1952, The theoretical variance within and among subdivisions of a population that is in a steady state. Genetic, 37, 312-321.
Zlatar, V., 1983, Replanteamiento sobre el problema Caleta Huelén 42. Chungara, 10, 21-28.