
Valverde, L., Elcoroaristizabal, X., Álvarez, A., Cardoso,
S., M. de Pancorbo, M., 2011, Nueva propuesta metodológica para la estimación de la
eficiencia energética de la Cadena de Transporte de Electrones mitocondrial en
linfocitos T CD4+. Antropo, 25, 1-9. www.didac.ehu.es/antropo
Nueva
propuesta metodológica para la estimación de la eficiencia energética de la
Cadena de Transporte de Electrones mitocondrial en linfocitos T CD4+
New
methodology approach to estimate the energetic efficiency of the Mitochondrial
Electron Transport Chain in CD4+ T-lymphocytes
Laura
Valverde, Xabier Elcoroaristizabal, Alejandra Álvarez, Sergio Cardoso, Marian
M. de Pancorbo
BIOMICs
Research Group, Centro de Investigación CIEA “Lucio Lascaray”, Universidad del
País Vasco, España.
Autor de correspondencia: Prof. Marian
Martínez de Pancorbo.
marian.mdepancorbo@ehu.es
Palabras clave: eficiencia energética,
cadena de transporte de electrones, CTE, mitocondria, CD4+
Keywords: energetic efficiency, electron transport chain, ETC, mitochondria, CD4+
Resumen
Los diferentes polimorfismos del ADN mitocondrial pueden
provocar cambios en la estructura de las proteínas involucradas en la cadena de
transporte de electrones y a su vez modificar el funcionamiento o eficiencia de
una de las principales funciones de la mitocondria, la fosforilación oxidativa.
Esto ha sido relacionado con numerosas enfermedades.
En este trabajo presentamos un nuevo procedimiento basado en
la medida combinada de tres parámetros indicadores del estado energético
mitocondrial, el potencial de membrana, la producción de anión superóxido y los
niveles de ATP. La evaluación conjunta de estos parámetros permite inferir la
funcionalidad de la cadena de transporte de electrones mitocondrial, y por
tanto, son buenos indicadores de la eficiencia energética de la misma.
Se han realizado ensayos de reproducibilidad en las medidas
de estos tres parámetros in vivo y en
cultivo, concluyendo que las medidas en cultivo muestran una reproducibilidad
mucho más adecuada para llevar a cabo estimas de eficiencia energética. Además,
la posibilidad de un control riguroso de los factores exógenos bajo cultivo
permite estimar también los cambios en el metabolismo mitocondrial tras el
sometimiento de un cultivo a condiciones como respuesta a fármacos, escasez de
alimentos,…Así, esta metodología permite realizar un ensayo individualizado de
la eficiencia del metabolismo energético mitocondrial, cuya importancia está en
constante aumento por su implicación en numerosos estados patógenos.
Abstract
The different DNA mitochondrial
polymorphisms can generate changes in the structure of the proteins involved in
the mitochondrial Electron Transport Chain, and therefore modify the
functionality or efficiency of one the principal functions of the mitochondria,
the oxidative phosphorilation. This has been related with several diseases.
In this study we present a new
methodology to estimate the mitochondrial energetic efficiency based on the
combined measurement of three indicators of the energetic state in the
mitochondria: the membrane potential, the production of reactive oxygen species
and the ATP levels.
The assays based on these three
indicators performed both in vivo and
in cell culture concluded that the reproducibility in cell culture was higher
and thus more suitable to carry out estimates of energetic efficiency.
Furthermore, cell cultures allow a strict control over the external conditions,
allowing the comparison of different individuals under controlled identical
conditions and their responses to changes in their environment, as drugs
addition, food scarcity, sudden temperature changes,…Thereby, this methodology
allows individualized assays of the mitochondrial energetic efficiency, which
is of great importance since energetic metabolism deficiencies are involved in
several pathogen states.
Introducción
La principal función de las mitocondrias es proveer a las
células de la mayoría del ATP que necesitan, mediante el proceso de
fosforilación oxidativa llevado a cabo en la cadena de transporte de electrones
(CTE) de la membrana mitocondrial interna. Las proteínas implicadas en este
proceso de fosforilación oxidativa son codificadas tanto por el genoma nuclear
como por el mitocondrial.
Durante los últimos años varios estudios han argumentado que
la existencia de polimorfismos en los genes que codifican estas proteínas,
especialmente los situados en el genoma mitocondrial, pueden ser responsables
de leves variaciones con gran repercusión en la eficiencia energética
mitocondrial. Las diferencias en el funcionamiento de la CTE han sido
relacionadas con enfermedades neurodegenerativas (van der Walt et al., 2003;
Martínez-Redondo et al., 2010), la penetrancia de algunas enfermedades (Brown,
1997; DiMauro and Schon, 2003; SanGiovanni et al., 2009), la movilidad de los
espermatozoides (Moore et al., 2000, Ruiz-Pesini et al., 2000; Montial-Sosa et
al., 2006) y también con la longevidad de diferentes poblaciones (Ivanova et
al., 1998; De Benedictis et al., 1999; Rose et al., 2001; Niemi et al., 2003; Cacabelos
et al., 2005; Santoro et al., 2006; Beckstead et al., 2009; Marcuello et al.,
2009).
La mitocondria lleva a cabo un importante papel de
mantenimiento de la homeostasis celular en varios órganos del cuerpo por lo que
el desarrollo de métodos de medida del estado metabólico y energético
mitocondrial ha sido propuesto incluso como herramienta farmacogenética
(Mayevsky and Barbiro-Michaely, 2009; Gómez-Durán et al., 2010).
En este trabajo presentamos un procedimiento sencillo y
eficaz para estimar la eficiencia energética mitocondrial a partir de las
medidas combinadas del potencial de la membrana mitocondrial, la producción de
anión superóxido y los niveles de ATP.
El potencial de membrana (MP) se genera por el bombeo de
protones desde la matriz hacia el espacio intermembrana de la mitocondria
gracias a la energía liberada del transporte electrónico en la CTE. El
gradiente electroquímico generado por el bombeo de protones permite que el
flujo de entrada de protones a favor de gradiente sea utilizado por la enzima
ATP sintasa para generar ATP o para el transporte de diversos sustratos al
interior de la mitocondria.
La situación más eficiente desde un punto de vista
energético tiene lugar cuando hay acoplamiento quimiosmótico, donde toda
energía del gradiente electroquímico se utiliza únicamente para generar ATP y
no hay liberación de calor. La cantidad de ATP producido en la mitocondria por
fosforilación oxidativa depende del porcentaje del gradiente electroquímico que
se utilice para otros fines diferentes a la síntesis de ATP. Normalmente más de
un 40% de esta energía electroquímica es convertida en enlaces fosfato de ATP.
La energía no utilizada se libera en forma de calor (Brookes 2005).
Los aniones superóxido se generan como un subproducto de la
fosforilación oxidativa. Un pequeño porcentaje del oxígeno utilizado por la CTE
queda reducido de manera incompleta y reacciona con el oxígeno molecular
generando esta especie reactiva de oxígeno (ROS). Los excesos de producción de
anión superóxido han sido relacionados con enfermedades neurogenerativas,
envejecimiento prematuro y con el cáncer (Wallace 2005).
Por todo lo anterior, la utilización de estos tres
parámetros, MP, ROS y ATP, es muy apropiada para realizar una estima minuciosa
del estado energético de la mitocondria.
El objetivo de este trabajo fue desarrollar un procedimiento
basado en la medida combinada de estos tres parámetros para la detección de la
eficiencia energética de la CTE, cuyas principales aplicaciones son realizar
comparaciones entre el estado energético de la misma población celular entre
individuos diferentes, o de la misma población celular en situaciones
diferentes.
La comprobación de la efectividad y sensibilidad de dichos
parámetros para la detección de la eficiencia energética de la CTE se llevó a
cabo en linfocitos T CD4+ de sangre periférica. Se seleccionó este tipo celular
por su abundancia y facilidad de obtención. La evaluación se llevó a cabo tanto
en condiciones normales como tras la aplicación de un shock térmico.
Los resultados mostraron que el ensayo mostraba mayor
reproducibilidad cuando los linfocitos T CD4+ eran puestos en cultivo en vez de
realizar las medidas directamente in vivo,
presumiblemente debido a un mayor control de los factores exógenos en cultivo,
lo que dotó a los resultados de mayor fiabilidad.
Material y métodos
Extracción de sangre
Las muestras de sangre periférica fueron extraídas a
voluntarios sanos en tubos con anticoagulante EDTA. Los voluntarios fueron
informados de los objetivos del estudio y dieron su consentimiento.
Separación magnética de linfocitos T CD4+
Este procedimiento debe realizarse dentro de las 48 horas
posteriores a la extracción de la sangre periférica para asegurar buen
rendimiento. Se centrifugó 1 ml de sangre periférica de cada individuo a 1500 g
durante 15 minutos para recuperar una fracción enriquecida en células blancas.
Posteriormente se realizó la lisis eritrocitaria mediante incubación con 1 ml
de la solución RBC Lysis del kit Puregene (Gentra Systems, Minneapolis, MN,
USA) durante 15 minutos de incubación, a continuación se centrifugó a 850 g
durante 10 minutos y se repitió el proceso. La fracción celular resultante de
la segunda lisis fue resuspendida en 500 µl de PBS y se procedió inmediatamente
al aislamiento de los linfocitos T CD4+ mediante el kit de
extracción magnético Dynabeads Flow Comp Human CD4 (Invitrogen), siguiendo las
recomendaciones del fabricante.
Cultivos celulares de
linfocitos T CD4+
Los linfocitos CD4 ya aislados, fueron centrifugados a 350 g
5 minutos para retirar los restos del buffer de extracción utilizado y ser
resuspendidos y puestos de manera inmediata en un medio de cultivo adecuado. El
medio de cultivo empleado fue RPMI suplementado con Suero Bovino Fetal al 10%,
Ampicilina (10 µl/ml), Estreptomicina-Penicilina (100 µl/ml), L-Glutamina 2mM
(10 µl/ml) y fitohematoglutinina (10 µl/ml). Los linfocitos se pusieron a
crecer en 1 ml de este medio de cultivo en una estufa a 37 °C y 5% de CO2.
Estima de la viabilidad celular
El contaje de número de células y estimas de viabilidad
celular se realizaron con un equipo automático TC10 (BioRad) a las 18 horas de
cultivo así como previamente a cada medida. La viabilidad fue detectada
mediante tinción con azul tripán (TC10 trypan blue dye, BioRad). Todas las medidas
se realizaron por triplicado.
Medida del potencial de membrana (MP) y de la
producción de especies reactivas de oxígeno (ROS)
La estimación del potencial de la membrana interna
mitocondrial se realizó utilizando el kit MitoStep
(Immunostep, Salamanca, Spain) que incluye la sonda catiónica DilC1(5).
La producción de anión superóxido en la mitocondria se midió
mediante el kit MitoSOX Red
(Invitrogen, Carlsbad, CA, USA).
Se mezclaron 50 µl de cada cultivo de linfocitos T CD4+
con 0,5 µl de la sonda DilC1(5) y 50 µl de solución MitoSOX Red 5µM. Se incubó en oscuridad 10 minutos a 37°C 5% CO2
y se procedió a la medida de la fluorescencia intracelular producida por ambas
sondas en un lector DTX880 (Beckman Coulter), en primer lugar la fluorescencia
derivada del MitoSOX empleando los
filtros 510/580 e inmediatamente después la fluorescencia derivada de la sonda
DilC1(5) con los filtros 633/658. Todas las medidas se realizaron por
triplicado.
Determinación de los niveles de ATP
Los niveles de ATP se midieron utilizando el ATP Determination Kit (Invitrogen,
Carlsbad, CA, USA) siguiendo las recomendaciones del fabricante. Previamente
los linfocitos T CD4+ fueron lisados mediante incubación a 95°C 15
minutos cada cultivo celular con un volumen igual de H2O MQ estéril.
Los lisados se mezclaron con los reactivos luciferina/luciferasa proporcionados
por el kit y la luminiscencia producida fue inmediatamente medida en el lector
DTX880 (Beckman Coulter). La recta patrón utilizada cubrió el rango entre 1 µM
y 1,9 nM de ATP en 10 diluciones de una muestra control de ATP de concentración
conocida.
Ensayos in vivo: citometría de flujo
Se realizó una tinción directa en sangre periférica (previa
lisis de eritrocitos) de los linfocitos T CD4+ con los anticuerpos
monoclonales CD4 CF Blue (Immunostep, Salamanca, Spain), conjuntamente con los
reactivos de los kits de medida de MP y ROS. Cada valor de fluorescencia fue
detectado mediante los filtros recomendados por los fabricantes.
Análisis de los resultados
Todos los valores obtenidos en las medidas de MP, ROS y ATP
fueron normalizados en base al número de células vivas para hacer posible su
intercomparación.
Los valores de fluorescencia normalizados fueron
representados de manera conjunta en gráficos Microsoft Excel para su interpretación.
Resultados y discusión
Este trabajo presenta una metodología sencilla, rápida y
coste-eficaz para estimar la eficiencia energética de la CTE mitocondrial
mediante la determinación y valoración conjunta de tres parámetros: el
potencial de membrana (MP), la producción de radicales superóxido (ROS) y los
niveles de ATP.
Durante el desarrollo de esta metodología se valoraron
diferentes técnicas de medida tanto in
vivo como en cultivo.
Las estimaciones in
vivo se realizaron mediante citometría de flujo, para lo cual se realizó
una tinción directa en sangre periférica de los linfocitos T CD4+
conjuntamente con los reactivos de los kits de medida de MP y ROS (Figura 1).
La medida de fluorescencia in vivo tiene las ventajas de poder realizar estimas de varios
parámetros de manera simultánea, lo que minimiza las variaciones que pudieran
surgir entre una medida y la siguiente, además de controlar con exactitud el
número de células objeto de las medidas. Sin embargo, los resultados obtenidos
no mostraron suficiente reproducibilidad. Se tuvo en cuenta la posible
influencia de condiciones ambientales tales como la ingesta de alimento o el
ejercicio físico previos a la extracción de sangre, así como el tiempo
transcurrido entre la extracción y la realización de las medidas. Para realizar
una estima de la reproducibilidad se compararon los resultados obtenidos de dos
partes alícuotas de una misma muestra de sangre normalizados en base al número
de células, y en dos individuos. Los resultados mostraron poca reproducibilidad
en las medidas realizadas 5 horas después de la extracción de sangre (Figura
2).
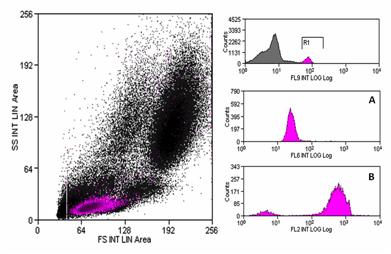
Figura 1. Ensayo in vivo mediante citometría de flujo. La
fracción sanguínea correspondiente a los linfocitos T CD4+ (fracción
R1) se muestra resaltada en color magenta. A) Fluorescencia correspondiente a
MP (filtro 6) y B) Fluorescencia correspondiente a ROS (filtro 9).
Figure 1. Flow
citometry in vivo assay. The
population of T CD4+ lymphocytes is signalled in pink (R1 fraction).
A)
MP fluorescence (filter 6) and B) ROS fluorescence (filter 9).
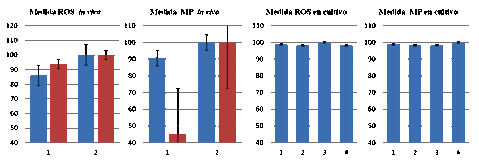
Figura 2. Medidas de ROS
y MP de linfocitos T CD4+ y sus errores estándar correspondientes.
Los datos in vivo se refieren a
medidas tomadas 5 horas tras la extracción de sangre periférica de dos
individuos diferentes (azul y rojo). La sangre fue dividida en 2 partes
alícuotas que se analizaron por separado. Los datos de las medidas in vitro se obtuvieron de cuatro
cultivos de linfocitos T CD4+ aislados de una única extracción de
sangre de un solo individuo, tras 24 h en cultivo.
Figure 2. ROS and MP measurements in T CD4+
lymphocytes. In vivo measurements
were done 5 hours after the extraction of peripherical blood from 2 different
individuals (blue and red). Blood was divided into two aliquots that were
analysed independently. In vitro
measurements were done in 4 T CD4+ lymphocyte cultures isolated from
a single blood extraction of 1 individual and after 24 hours of growing in
culture.
La falta de reproducibilidad observada nos hizo descartar la
estima de la eficiencia de la CTE in vivo,
y con ello evitar la complejidad de someter de manera rigurosa a los donantes a
condiciones ambientales similares.
En cambio, los resultados obtenidos de las medidas de
fluorescencia de ROS y MP in vitro,
normalizadas según el número de células, mostraron una gran reproducibilidad (Figura
2). En concreto, se realizaron tres medidas consecutivas (en el gráfico se
presenta la media) de 4 cultivos obtenidos a partir de una única extracción de
sangre realizada a un individuo. Las medias de cada cultivo no mostraron
diferencias significativas entre sí (p>0,05), corroborando la
reproducibilidad del método en cultivo.
En cuanto a la evaluación del método y tiempo de medida más
adecuados para estimar los niveles de ATP intracelular, se realizaron varios
ensayos con concentraciones conocidas de ATP dirigidos en primer lugar a
estimar el mejor método de lisis celular. La adición de detergentes aniónicos
suaves como el SDS para la lisis celular mostró interferencias en las medidas
de luminiscencia posteriores. Por ello nos decantamos por la adición de un
volumen 1:1 de H2O MQ esterilizada seguida de un calentamiento durante 5
minutos a 95ºC, lo cual no mostró interferencias en las medidas posteriores.
La estimación del momento más adecuado para estimar los
niveles de ATP se realizó mediante la comparación los valores de luminiscencia
de dilución de la recta patrón de ATP (10 diluciones de una muestra de
concentración conocida de ATP, desde 1µM de ATP hasta 1,9 nM ATP) obtenidos
cada 138 segundos (Figura 3). La cinética permitió comprobar que los valores de
luminiscencia caían rápidamente con el transcurso del tiempo. Esto indicó la
necesidad de realizar las medidas en todos los cultivos con un alto control del
tiempo transcurrido tras la adición de la enzima (luciferasa) y sustrato
(luciferina), desencadenantes de la reacción luminiscente.
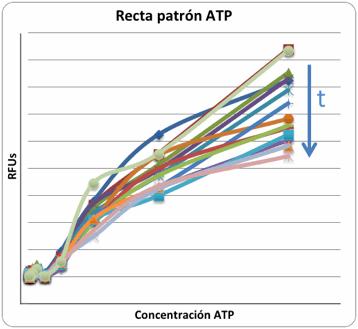
Figura 3. Rápida pérdida
de luminiscencia con el transcurso del tiempo tras el inicio de la reacción
luminiscente luciferasa/luciferina utilizada para estimar los niveles
intracelulares de ATP.
Figure 3. Loss of intensity in luminescent
signal with time since the beginning of the lucipherase/lucipherine enzymatic reaction
used for estimating ATP intracellular levels.
Por tanto, el flujo de trabajo de la metodología propuesta
para la estima de la eficiencia energética de la CTE mitocondrial quedaría tal
y como se muestra en la figura 4.
La figura 5 muestra un ejemplo de las medidas realizadas a
dos individuos sanos (A y B) en condiciones normales a las 24h de cultivo y
tras someterlos a un shock por falta de alimentos y bajada de la temperatura.
Concretamente, a las 24 horas de cultivo se tomó una alícuota de los mismos y
se colocaron durante 6 horas en un medio de cultivo sin suero bovino fetal y a
4°C.
Puede observarse que en condiciones normales ambos cultivos
presentan un comportamiento similar para los 3 parámetros (ROS, MP y ATP),
aunque el individuo B en niveles algo menores. En cambio, cada individuo
reacciona de manera diferente al shock. Mientras el individuo A disminuye sus
niveles de MP y ROS, el individuo B muestra disminución de ROS pero un aumento
de MP y ATP. El aumento de MP puede estar relacionado con la necesidad de
bombear más protones al espacio intermembrana para incrementar el gradiente
electroquímico no sólo para generar más ATP, sino para activar el metabolismo
de las grasas y generar más calor en respuesta al shock frío (Mishmar et
al.,2003; Brookes 2005).
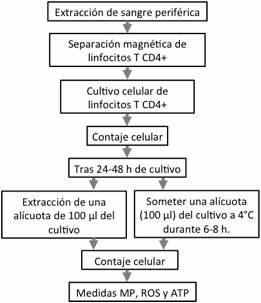
Figura 4. Metodología
para estimar la eficiencia de la CTE mitocondrial.
Figure 4. Workflow to estimate the efficiency
of the mitochondrial Electron Transport Chain.
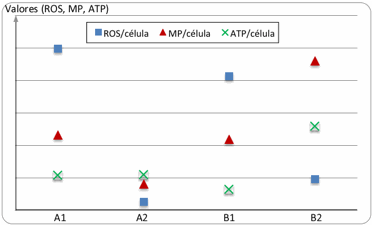
Figura 5. Comportamiento
de los cultivos A y B en condiciones normales (A1, B1) y tras un shock de falta
de alimento y frío (A2, B2). Todos los parámetros fueron normalizados en base
al número de células vivas.
Figure 5. Behaviour of the cell cultures A
and B in normal conditions (A1, B1) and
after a shock based in lack of food and cold (A2, B2). All the parameters were normalized in base of the number of life
cells.
En conclusión, la eficiencia y reproducibilidad de la
técnica propuesta indica que el estudio de los linfocitos T CD4+ in vitro es una forma adecuada para
realizar estimas de eficacia de la CTE y además ofrece varias ventajas, siendo
la principal la posibilidad de controlar rigurosamente los factores exógenos.
Esta técnica también ofrece la posibilidad de realizar estudios
individualizados de la eficiencia energética mitocondrial de la CTE, cada día
más reconocida como causa de varios estados patológicos (Mayevsky and
Barbiro-Michaely, 2009; Gómez-Durán et al., 2010).
Agradecimientos. Los autores
agradecen el apoyo técnico y humano de los SGIker (UPV/EHU, MICINN, GV/EJ,
FSE), especialmente el de A. Díez. También quieren agradecer la colaboración
del Servicio de Citometría del Hospital de Valdecilla, especialmente a E. del
Cerro.
Referencias
Beckstead, W.A., Ebbert, M.T., Rowe, M.J., McClellan, D.A., 2009,
Evolutionary pressure on mitochondrial cytochrome b is consistent with a role
of CytbI7T affecting longevity during caloric restriction, PLoS One, 4(6),
e5836.
Brookes, P.S., 2005, Mitochondrial H (+) leak and ROS generation: an odd
couple, Free Radic. Biol. Med., 38(1), 12-23.
Brown, G.K., 1997, Bottlenecks and beyond: Mitochondrial DNA segregation
in health and disease, J. Inherit. Metab. Dis., 20 (1), 2-8.
Cacabelos, R., Fernandez-Novoa, L., Lombardi, V., Kubota, Y., Takeda,
M., 2005, Molecular genetics of Alzheimer’s disease and aging, Methods Find.
Exp. Clin. Pharmacol, 27 (Suppl A), 1-573.
De Benedictis, G., Rose, G., Carrieri, G., De Luca, M., Falcone, E.,
Passarino, G., Bonafe, M., Monti, D., Baggio, G., Bertolini, S., Mari, D.,
Mattace, R., Franceschi, C., 1999, Mitochondrial DNA inherited variants are
associated with successful aging and longevity in humans. FASEB J, 13 (12),
1532-1536.
DiMauro, S., Schon, E.A., 2003, Mitochondrial respiratory-chain
diseases, N. Engl. J. Med, 348 (26), 2656-2668.
Gómez-Durán, A., Pacheu-Grau, D., López-Gallardo, E., Díez-Sánchez, C.,
Montoya, J., López-Pérez, M.J., Ruiz-Pesini, E., 2010, Unmasking the causes of
multifactorial disorders: OXPHOS differences between mitochondrial haplogroups,
Hum. Mol. Genet., 19 (17), 3343-53.
Ivanova, R., Lepage, V., Charron, D., Schächter, F., 1998, Mitochondrial
genotype associated with French Caucasian centenarians, Gerontology, 44 (6),
349.
Marcuello, A., Martínez-Redondo, D., Dahmani, Y., Casajús, J.A.,
Ruiz-Pesini, E., Montoya, J., López-Pérez, M.J., Díez-Sánchez, C., 2009, Human
mitochondrial variants influence on oxygen consumption, Mitochondrion, 9 (1),
27-30.
Martínez-Redondo, D., Marcuello, A., Casajús, J.A., Ara, I., Dahmani,
Y., Montoya, J., Ruiz-Pesini, E., López-Pérez, M.J., Díez-Sánchez, C., 2010,
Human mitochondrial haplogroup H: the highest VO2max consumer--is it a
paradox?,
Mayevsky, A., Barbiro-Michaely E., 2009, Use of NADH fluorescence to
determine mitochondrial function in vivo, The International Journal of
Biochemistry & Cell Biology ,41, 1977-1988.
Mishmar, D., Ruiz-Pesini, E., Golik, P., Macaulay, V., Clark, A.G.,
Hosseini, S., Brandon, M., Easley, K., Chen, E., Brown, M.D., Sukernik, R.I.,
Olckers, A., Wallace, D.C., 2003, Natural selection shaped regional mtDNA
variation in humans, Proc. Natl. Acad. Sci. U.S.A., 100 (1), 171-6.
Montiel-Sosa, F., Ruiz-Pesini, E., Enríquez, J.A., Marcuello, A.,
Díez-Sánchez, C., Montoya, J., Wallace, D.C., López-Pérez, M.J., 2006,
Differences of sperm motility in mitochondrial DNA haplogroup U sublineages,
Gene, 368, 21-27.
Moore, F.L. y Reijo-Pera, R.A, 2000, Male Sperm Motility Dictated by
Mother’s mtDNA, Am. J. Hum. Genet., 67, 543-548.
Niemi, A.K., Hervonen, A., Hurme, M., Karhunen, P.J., Jylhä, M.,
Majamaa, K., 2003. Mitochondrial DNA polymorphisms associated with longevity in
a Finnish population. Hum. Genet., 112 (1), 29-33.
Rose, G., Passarino, G., Carrieri, G., Altomare, K., Greco, V.,
Bertolini, S., Bonafè, M., Franceschi, C., De Benedictis, G., 2001, Paradoxes
in longevity: sequence analysis of mtDNA haplogroup J in centenarians, Eur. J.
Hum. Genet, 9 (9), 701-707.
Ross, O.A., McCormack, R., Curran, M.D., Duguid, R.A., Barnett, Y.A.,
Rea, I.M., Middleton, D., 2001, Mitochondrial DNA polymorphism: its role in
longevity of the Irish population. Exp. Gerontol, 36 (7), 1161-1178.
Ruiz-Pesini, E., Lapena, A.C., Díez-Sánchez, C., Pérez-Martos, A.,
Montoya, J., Alvarez, E., Díaz, M., Urriés, A., Montoro, L., López-Pérez, M.J.,
Enríquez, J.A., 2000, Human mtDNA haplogroups associated with high or reduced
spermatozoa motility, Am. J. Hum. Genet, 67 (3), 682-696.
SanGiovanni, J.P., Arking, D.E., Iyengar, S.K., Elashoff, M., Clemons,
T.E., Reed, G.F., Henning, A.K., Sivakumaran, T.A., Xu, X., DeWan, A., Agrón,
E., Rochtchina, E., Sue, C.M., Wang, J.J., Mitchell, P., Hoh, J., Francis,
P.J., Klein, M.L., Chew, E.Y., Chakravarti, A., 2009, Mitochondrial DNA
variants of respiratory complex I that uniquely characterize haplogroup T2 are
associated with increased risk of age-related macular degeneration, PLoS One,
4(5), e5508.
Santoro, A., Salvioli, S., Raule, N., Capri, M., Sevini, F., Valensin,
S., Monti, D., Bellizzi, D., Passarino, G., Rose, G., De Benedictis, G.,
Franceschi, C., 2006, Mitochondrial DNA involvement in human longevity,
Biochim. Biophys. Acta, 1757 (9-10), 1388-1399.
van der Walt, J.M., Nicodemus, K.K., Martin, E.R., Scott, W.K., Nance,
M.A., Watts, R.L., Hubble, J.P., Haines, J.L., Koller, W.C., Lyons, K., Pahwa,
R., Stern, M.B., Colcher, A., Hiner, B.C., Jankovic, J., Ondo, W.G., Allen,
F.H., Goetz, C.G., Small, G.W., Mastaglia, F., Stajich, J.M., McLaurin, A.C.,
Middleton, L.T., Scott, B.L., Schmechel, D.E., Pericak-Vance, M.A., Vance,
J.M., 2003, Mitochondrial polymorphisms significantly reduce the risk of
Parkinson disease, Am. J. Hum. Genet., 72 (4), 804-811.
Wallace D.C., 2005, A mitochondrial paradigm of metabolic and
degenerative diseases, aging, and cancer: a dawn for evolutionary medicine,
Annu. Rev. Genet., 39, 359–407.