
Odriozola
A, Aznar JM, De Pancorbo MM., 2010, Estandarización de la búsqueda y genotipado
de polimorfismos de un solo nucleótido mediante DHPLC-AAS. Antropo, 23, 11-29.
www.didac.ehu.es/antropo
Estandarización de
la búsqueda y genotipado de polimorfismos de un solo nucleótido mediante
DHPLC-AAS
Standardization
of the search and genotyping of single nucleotide polymorphisms by DHPLC-GA
A. Odriozola, J.M Aznar, M.M De Pancorbo
BIOMICS Group. Dept. Zoología y Biología Celular Animal. Facultad de Farmacia, Universidad del País Vasco, 01006, Vitoria-Gasteiz, Álava, Spain.
Correspondencia: Marian M. de Pancorbo. Dept. Zoología y
Biología Celular Animal. Facultad de Farmacia, Universidad del País Vasco,
01006, Vitoria-Gasteiz, Álava, Spain. marian.mdepancorbo@ehu.es
Palabras Clave: DHPLC, SNP, polimorfismo, metodología, estandarización, Analizador Automático de Secuencias, dominio de melting.
Keywords: DHPLC, SNP, methodology,
standardization, genetic analyzer, melting domain.
Resumen
El binomio Cromatografía Líquida de Alta Presión en condiciones Desnaturalizantes-Analizador Automático de Secuencias (DHPLC-ASS) presenta una elevada sensibilidad y especificidad en la búsqueda y genotipado de variaciones de tipo SNP (polimorfismos de base única), por lo que tiene aplicaciones tales como el diagnóstico molecular de mutaciones.
Esta herramienta requiere de un fino diseño y optimización de la metodología de análisis de cada amplicón. En este trabajo se presentan pautas globales para la estandarización de los métodos de análisis por DHPLC-AAS. Así mismo se describen dos metodologías adicionales para incrementar el rendimiento del análisis por DHPLC que consisten en: a) la reducción del tiempo de análisis por DHPLC y b) la semiautomatización de la amplificación PCR mediante SDDA (Simple Dryed DHPLC Analisis).
Summary
This approach requires a fine design and optimization of the methodology
necessary to analyze each amplicon. In this study we present the main
guidelines for the standardization of analysis methods by DHPLC-GA.
Furthermore, we describe two additional methodologies to increment the
throughput of DHPLC analysis that consists of: a) reduction of time required
for DHPLC analysis and b) semiautomatization of PCR amplification by SDDA (Simple
Dryed DHPLC Analysis).
The set of methods presented herein offers the possibility to obtain a
high-throughput of the couple DHPLC-GA in all its many applications.
Introducción
Hoy día existen múltiples tecnologías destinadas al análisis de variaciones de tipo SNPs (Single Nucleotide Polymorphisms) Kwok et al. (2003). En este sentido, el binomio Cromatografía Líquida de Alta Presión en condiciones Desnaturalizantes-Analizador Automático de secuencias (DHPLC-AAS) constituye una herramienta de elevada sensibilidad y especificidad Yu et al. (2006) para la búsqueda y el genotipado de dichos polimorfismos genéticos (Lilleberg, 2003; Frueh et al., 2003).
Por todo ello ha sido ampliamente utilizada tanto en la investigación oncológica (Balogh et al., 2004; Tian et al., 2008; Wirtz et al., 2007; Hansen et al., 2008; Xie et al., 2004; Ye et al., 2006a y b) y en el diagnóstico molecular de multitud de enfermedades genéticas (Ning et al., 2008; Liu et al., 2008), como en Genética forense (Underhill et al., 1997; Danielson et al., 2007; Jiang et al., 2006; Shi et al., 2007; Soejima and Koda, 2005).
La tecnología DHPLC-AAS es altamente sensible y versátil, capaz de ofrecer un mediano rendimiento (Hegde and Roa, 2006) a bajo coste (Underhill et al., 1997) en la detección de variaciones de tipo SNPs en un amplio rango de amplificados (150 – 1500 pb).
Por otro lado, es también de utilidad en el análisis de STRs (Short Tandem Repeats), ya que permite incluso la captura física de los amplicones correspondientes a los diferentes alelos, mediante colectores de fracciones, para su posterior secuenciación (Devaney et al., 2000).
La tecnología DHPLC-AAS, requiere de métodos de análisis específicos para la detección de variaciones tipo SNPs a lo largo de la totalidad de la secuencia comprendida en cada amplicón (Wurzburger et al., 2003), en contraposición al uso exclusivo de la secuenciación directa, en la que los métodos de análisis pueden variar únicamente en los cebadores utilizados en cada caso.
En este sentido
señalar que los métodos de análisis por DHPLC-AAS, se caracterizan por un
diseño pormenorizado que puede resultar complejo debido al elevado número de
parámetros a considerar, tales como la localización y frecuencia de SNPs
previamente descritas en esas regiones, el tamaño del amplicón, los dominios de
melting (DM) y la temperatura o rango de
temperaturas óptimas para el análisis. Por lo que, el diseño de los diferentes
métodos de análisis tiene una importancia crucial en el rendimiento final de
los ensayos por DHPLC en cuanto a sensibilidad y rapidez.
Por lo tanto, aunque el DHPLC permite analizar un elevado número de muestras en un tiempo reducido, cabe reseñar que el diseño y la optimización de cada método de análisis son procesos que pueden retrasar la obtención de resultados.
La presente metodología global de estandarización de los análisis por DHPLC-AAS persigue los siguientes objetivos:
1. Simplificar la puesta a punto en fases concretas y fáciles de ejecutar.
2. “Feedback” en la secuencia de las fases para poder volver a atrás con el fin de detectar y resolver problemas.
3. Aumentar la calidad y robustez del diseño.
4. Agilizar la optimización simultánea de diversos métodos de análisis mediante la homogenización de los diseños.
5. Aumentar la probabilidad de éxito en la búsqueda y genotipado de SNPs.
6. Aumentar el rendimiento y reducir los costes.
En síntesis, esta metodología ha sido diseñada para ser de utilidad en un amplio rango de métodos de análisis y se basa en la segmentación de los procesos en etapas menores caracterizadas por requerimientos mínimos que hay que superar antes de progresar a la siguiente fase.
Además, se proponen dos metodologías adicionales que permiten incrementar el rendimiento del análisis por DHPLC: la reducción del tiempo de análisis y la semiautomatización de la amplificación PCR por SDDA (Simple Dryed DHPLC Analisis).
Los resultados obtenidos muestran que la metodología desarrollada en este trabajo favorece la estandarización y a su vez, ofrece un elevado rendimiento en los análisis realizados mediante DHPLC-AAS.
Fundamento de
la tecnología DHPLC
La Cromatografía Líquida de Alta Presión en condiciones Desnaturalizantes (DHPLC) es una técnica de separación de ácidos nucleicos en un amplio rango de temperaturas acoplada a un detector ultravioleta, que posibilita la detección cualitativa y en algunos casos cuantitativa de las moléculas de ADN.
La separación de moléculas de ADN por DHPLC se debe a la interacción entre el ADN y una columna cromatográfica de naturaleza hidrofóbica, compuesta por cadenas de 18 carbonos dispuestas sobre un lecho de poliestireno-divinilbenceno (PSDVB). El enlace del ADN a la columna se produce gracias a la interacción con un agente anfipático incluído en la fase móvil (acetato de trietilamonio, TEAA) (Transgenomic, 2003-2005). La elución del ADN retenido se lleva a cabo mediante la ruptura de la unión ADN - TEAA, favorecida por la presencia de acetonitrilo en la fase móvil.
Por lo tanto cabe señalar que, la elución del ADN de la columna depende en gran manera del gradiente lineal de acetonitrilo aportado por la fase móvil.
Esta tecnologia se caracteriza por su versatilidad, así en condiciones totalmente desnaturalizantes (75 – 80 ºC) es capaz de determinar el tamaño de amplificado y en condiciones no desnaturalizantes (~ 50 ºC) permite además cuantificar el mismo.
Señalar que, en condiciones semidesnaturalizantes (52 – 75 ºC) posibilita también la detección de SNPs (Transgenomic, 2003-2005). Esta detección por DHPLC precisa de la amplificación previa por PCR de las regiones genómicas de interés, tras lo cual los amplicones son sometidos a heteroduplexización (figura 1). En este proceso los amplicones en homocigosis se desnaturalizan y posteriormente se renaturalizan lentamente para dar lugar a homodúplex. Por otro lado, los amplicones heterocigotos para variaciones del tipo SNPs dan lugar a la formación de moléculas de doble hebra que contienen un desapareamiento en la posición polimórfica. A estas moléculas parcialmente complementarias se les conoce como heterodúplex.
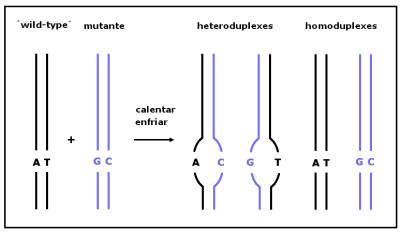
Figura 1. Representación del proceso de heteroduplexización, en el que se
forman homoduplex y heteroduplex mediante la desnaturalización y posterior
renaturalización de las diferentes hebras de ADN.
Figure 1. Schematic representation of the process of heteroduplexization, in which homoduplex and heteroduplex are formed by denaturation and subsequent renaturation.
La detección de SNPs por DHPLC se basa en las diferencias existentes en las propiedades termodinámicas del ADN entre moléculas de doble hebra plenamente complementarias (homodúplex) y aquellas que muestran desapareamiento (heterodúplex) (Yu et al., 2006), debido a que, en condiciones semidesnaturalizantes las moléculas heterodúplex se encuentran ligeramente más desnaturalizadas que las homodúplex y su carga negativa global es menor. En consecuencia, los heterodúplex son retenidos en menor medida por el lecho cargado positivamente con TEAA y por tanto, eluyen en la columna antes que los homodúplex (Hou and Zhang, 2000).
Por ello se puede establecer que, la determinación de la temperatura de análisis es un parámetro crucial en la detección diferencial de homodúplex y heterodúplex (Xiao and Oefner, 2001).
La detección de diferencias entre homodúplex y heterodúplex mediante DHPLC, puede realizarse rápidamente por la presencia en el cromatograma de un pico (Figura 2A) o de un número mayor de picos (Figura 2B), correspondientes todos ellos respectivamente, con aquellos análisis de muestras que posean únicamente homodúplex (homocigotas para ese amplicón) o bien con los que además incluyan heterodúplex (heterocigotas para ese amplicón).
La diferenciación entre homocigotos para diferentes alelos por DHPLC, se realiza mediante la mezcla antes de la heteroduplexización, de un amplicón problema y un amplicón de referencia, en este caso un homocigoto de genotipo conocido.
Por lo que, tras el posterior análisis de la mezcla heteroduplexizada por DHPLC, se va detectar un único pico correspondiente a las moléculas homodúplex (figura 2A), cuando se cumpla el requisito de que el amplicón problema y el amplicón de referencia sean homocigotos para el mismo alelo.
Mientras que, si por el contrario son homocigotos para distinto alelo se va a detectar más de un pico en el cromatograma, ello es debido a la presencia en la muestra tanto de homodúplex como de heterodúplex (figura 2B).
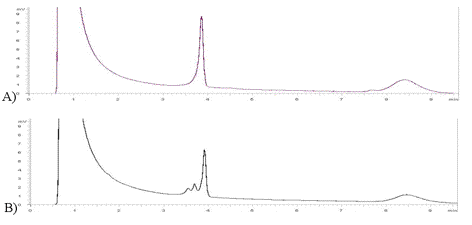
Figura 2. A) Cromatograma correspondiente al análisis por DHPLC de un individuo
en el que se observa ún unico pico correspondiente a la detección de los
homodúplex. B) Cromatograma resultante del análisis por DHPLC de un individuo
en el que se distinguen varios picos correspondientes a la presencia de los
homodúplex y a los heterodúplex.
Figure 2. A) Chromatogram obtained by DHPLC analysis of an individual with a single peak which corresponds to the detection of the homoduplex. B) Chromatogram obtained by DHPLC analysis of an individual with various peaks which correspond to the detection of the homoduplex and heteroduplex.
Figura
3. Resumen de la estrategia planteada para la
Selección del Amplicón.
Figure 3. Summary of the
strategy proposed for amplicon selection.
Resultados
Estandarización de procesos
A continuación, se
presenta una metodología global para la optimización tanto de la selección del
amplicón (Figura 3), como del análisis por DHPLC del mismo (Figura 5). Así
mismo, se proponen dos nuevas metodologías para el aumento del rendimiento del
análisis por DHPLC que consisten en: a) la reducción del tiempo de análisis por
DHPLC y b) la semiautomatización de la amplificación PCR mediante SDDA (Simple
Dryed DHPLC Analisis).
Selección del amplicón
La selección del amplicón es un aspecto crucial en la detección de variaciones del tipo SNPs por DHPLC-AAS. Esta elección requiere la consideración de numerosas variables y puede resumirse en siete etapas: 1) elección de SNPs, 2) determinación de dominios de melting en la región de interés, 3) selección de temperaturas teóricas de análisis, 4) determinación del tamaño de amplicón, 5) diseño de cebadores, 6) amplificación PCR y heteroduplexización de los amplicones y 7) análisis de los amplicones mediante DHPLC.
Caracterización de SNPs en la región de interés
Este proceso comprende dos etapas de suma importancia en el diseño del estudio:
1. En primer lugar, se realiza la búsqueda de la secuencias de ADN de interés mediante el motor de búsqueda del NCBI (http://www.ncbi.nlm.nih.gov/) y Ensembl (http://www.ensembl.org/index.html).
2. Posteriormente, se procede a la búsqueda de aquellas variaciones de tipo SNPs previamente descritas en la secuencia de interés, así como de sus frecuencias poblacionales, en el caso de que hayan sido estudiadas, mediante SNP-BLAST (www.ncbi.nlm.nih.gov/SNP/snpblastByChr.html) y se señala su localización en la secuencia de ADN.
Este procedimiento permite valorar tanto la abundancia de posiciones del tipo SNPs en la región de interés, como la probabilidad de que estas posiciones variables muestren un comportamiento polimórfico en los extractos de ADN analizados.
Determinación de los dominios de melting (DM)
El factor determinante en la detección de variaciones tipo SNPs por DHPLC es la estabilidad térmica de la doble hélice de ADN, de tal forma que la longitud y la secuencia del amplicón determinan su patrón de desnaturalización térmica.
Cabe reseñar que, el término Temperatura de melting (Tm), se emplea para denominar la temperatura a la que, la mitad de las moléculas de un fragmento determinado de ADN se encuentran en forma de doble hebra y la otra mitad desnaturalizadas (SantaLucia, 1998).
Sin embargo, la desnaturalización no tiene lugar de forma homogénea a lo largo de la secuencia de ADN, sino que ésta se produce por regiones denominadas dominios de melting (DM). Un DM comprende una secuencia de nucleótidos de ADN que exhibe un comportamiento uniforme ante la desnaturalización térmica, esto es, se desnaturaliza en un rango de temperatura inferior a 3ºC (Wurzburger et al., 2003). Por lo tanto, en la selección del amplicón para su análisis por DHPLC, además de referirnos a la Tm del fragmento completo de ADN, hay que considerar también la Tm en cada región nucleotídica del amplicón y así establecer los distintos DMs. Dicha Tm depende tanto de la secuencia de nucleótidos, como de la longitud total.
En líneas generales, la tecnología DHPLC alcanza su mayor resolución en el análisis de amplicones de Tm uniforme que contengan un único DM (Wurzburger et al., 2003).
DNA Page del Navigator Software V.2.0.0. (Transgenomic, Glasgow, UK)
La aplicación DNA Page del Navigator Software V.2.0.0. (Transgenomic, Glasgow, UK) permite determinar los dominios de melting que componen la secuencia de interés. Dicha aplicación presenta cierta complejidad, no obstante su uso puede simplificarse de la siguiente manera (Figura 4A y 4B).
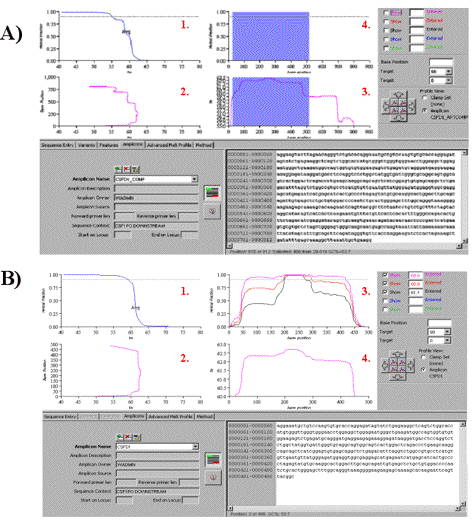
Figura 4. Resultado del análisis amplicón problema (A) y
amplicón óptimo (B) mediante la aplicación DNA Page del Navigator Software
V.2.0.0. en los diferentes paneles (1-4).
Figure 4. Summary of the
strategy proposed for the analysis of amplicons by DHPLC.
En la Figura 4A se observa la totalidad de la secuencia de interés, en este caso correspondiente a 800 pb de la región flanqueante aguas abajo del locus CSF1PO. En la figura 4.B se representa el amplicón seleccionado a partir de la secuencia de la figura 4.A por ser óptimo para su análisis por DHPLC. Esta selección se realiza en base a los requerimientos mínimos evaluados a continuación.
En primer lugar, se considera un amplicón adecuado aquel cuya fracción helicoidal decrezca un 90 % en un rango de Tm inferior a 5ºC. En este sentido, ambas figuras, 4A y 4B, presentan la misma estructura dividida en cuatro paneles, donde en el panel 1 se representa la fracción de la secuencia en forma helicoidal vs. Tm. Así en el panel 1 de la figura 4.A puede observarse que la secuencia completa requiere de un rango de Tm aproximado de 10ºC para que su fracción helicoidal decrezca en un 90%, mientras que el amplicón seleccionado, figura 4B, panel 1, requiere tan solo un rango de Tm de 5ºC.
En segundo lugar, es necesario determinar los diferentes DMs de la secuencia evaluada. Los paneles 2 y 3 de ambas figuras representan respectivamente, la posición nucleotídica vs. Tm y la Tm vs. posición nucleotídica, por lo que permiten establecer los diferentes DMs de la secuencia evaluada, en este caso 2 DMs en la secuencia de la Figura 4.A y 1 DM en la de la figura 4.B. Así mismo posibilita la determinación de la extensión de estos DMs en pares de bases y su posición en la región de interés, con el fin de seleccionar un amplicón de Tm lo más homogénea posible.
Por último, en los paneles 4 de ambas figuras se representa la fracción helicoidal vs. posición nucleotídica, cuya utilidad se detalla posteriormente en el apartado “3. Determinación de temperatura de análisis”.
Análisis de amplicones que no cumplan los requerimientos mínimos
No todos los amplicones son adecuados para su análisis por DHPLC. A modo de ejemplo cabe señalar que en un amplicón con dos DMs, que difieran en más de 3ºC entre sí, puede que únicamente se logre la detección de SNPs contenidos en el DM de menor temperatura. Así pues, en aquellos casos en los que la variación del tipo SNP se encuentre localizada en el DM de mayor temperatura se infiere que, la temperatura de análisis que produzca condiciones semidesnaturalizantes en la posición del desapareamiento, generará también la desnaturalización de DMs de menor Tm. En consecuencia, tanto homoduplex como heteroduplex se hallarán semidesnaturalizadas de tal forma que las diferencias de fracción helicoidal entre ambas serán insuficientes para su separación por DHPLC.
En este sentido señalar que, existen al menos dos estrategias para el análisis de amplicones que no cumplan aquellos requerimientos mínimos que garanticen su resolución por DHPLC:
1. CG-clamps. Las CG-clamps consisten en secuencias ricas en citosinas y guaninas de longitud variable (15, 20, 30 y 40 pb) que pueden añadirse a uno o a ambos cebadores, para la generación de un DM adicional en el amplicón y así posibilitar la detección de SNPs en regiones del amplicón que no cumplan los requerimientos mínimos. La Tm de este DM adicional aumenta con la longitud de la CG-clamp, de forma que, para garantizar la eficacia de esta estrategia, el DM generado por la adición de la CG clamp debe poseer una temperatura de melting al menos 8ºC superior a la del DM en el que se encuentre el SNP de interés (Wurzburger et al., 2003).
2. Análisis a diferentes temperaturas. El
análisis de un amplicón a diferentes temperaturas puede incrementar la
sensibilidad de la detección de SNPs alojados en DMs distintos al DM de menor
temperatura.
El uso de CG-clamps
es más eficaz que el análisis a diferentes temperaturas, sin embargo, su
optimización puede resultar complicada.
Selección de
temperaturas teóricas de análisis
Existen dos corrientes respecto a la elección de la temperatura óptima para el análisis por DHPLC de un amplicón. En la primera se recomienda el uso de aquella temperatura en la que 90 % del amplicón (ó un DM concreto, según el caso) se encuentre en forma de doble hebra (Wurzburger et al., 2003).
La segunda, se inclina por la utilización de temperaturas de análisis cercanas a la Tm del amplicón, esto es, en las que el porcentaje de amplicones en forma de doble hebra ronde el 50 %. Los análisis basados en esta segunda hipótesis se denominan TmHPLC (Temperature modulated High Performance Liquid Crhomatography) (Hou and Zhang, 2000). Ambas posibilidades proporcionan un rango de temperatura de análisis cercano al determinado posteriormente en la práctica.
La determinación de temperaturas de análisis teóricas para cada amplicón puede realizarse mediante la aplicación DNA Page del Navigator Software V.2.0.0. (Transgenomic, Glasgow, UK). En esta aplicación, tal y como se observa en el panel 3 de la figura 4 se representa la fracción helicoidal vs. posición nucleotídica, de modo que es posible observar la fracción helicoidal de cada posición nucleotídica a diferentes temperaturas y así en función de la opción seleccionada, escoger el rango de temperatura en el que bien del 75 al 90% o bien el 50% del amplicón, se encuentre en forma de doble hélice.
Determinación del tamaño de amplicón óptimo
La tecnología DHPLC ofrece una elevada sensibilidad y especificidad en el análisis de amplicones de tamaños comprendidos en un rango aproximado de 150 – 1500 pb.
El tamaño óptimo del amplicón está condicionado principalmente por:
1. El número de DMs presentes en la secuencia: un amplicón de gran tamaño con un elevado número de DMs puede ofrecer una pobre resolución en la detección de variaciones del tipo SNPs.
2. El número de SNPs probables por amplicón: amplicones que comprendan más de 2 SNPs dan lugar a seis o más genotipos posibles y por tanto de cromatogramas, lo que puede complicar tanto su distinción, como la determinación de la correspondencia cromatograma – genotipo.
3. El objetivo del ensayo: el genotipado de SNPs previamente descritas, requiere de la selección de amplicones del menor tamaño posible con el fin de reducir la probabilidad de que variaciones distintas a las de interés puedan interferir en los análisis. Mientras que en general, la probabilidad de éxito en la búsqueda de nuevas variaciones SNPs crece a medida que aumenta el tamaño del amplicón.
De todas maneras, es difícil determinar de antemano el tamaño de amplicón óptimo en la búsqueda de nuevas variaciones, pues la presencia de un número excesivo de SNPs dificulta su genotipado.
En este supuesto, en un primer momento se recomienda el uso de amplicones del mayor tamaño posible y de ser necesaria, la posterior selección de amplicones más pequeños que permitan el genotipado de 1 – 2 SNPs por análisis.
Diseño de cebadores
La estandarización del diseño de cebadores favorece la amplificación de diferentes secuencias de ADN en las mismas condiciones de PCR, de tal forma que establecer una serie de directrices en el programa Perlprimer (http://perlprimer.sourceforge.net/), facilita la obtención de parejas de cebadores aptas para su amplificación en el mismo protocolo de PCR.
Por tanto, los cebadores deben de cumplir los siguientes requisitos:
1. Tener de 18 a 25 pbs de longitud.
2. Que 2 de los 3 nucleótidos del extremo 3´ estén constituidos por G ó C, para así contribuir a estabilizar la unión de los cebadores a la secuencia diana.
3. Presentar Tms en el rango de 60 a 65 ºC.
4. No formar dímeros extensibles.
5. No formar dímeros no extensibles con incrementos de Energía Libre de Gibbs (∆ºG) inferiores a -5 Kcal /mol a temperaturas de 37 ºC.
Se recomienda adquirir cebadores previamente analizados por HPLC para determinar su pureza, dado que el DHPLC es una técnica muy sensible y la impureza de los cebadores puede provocar la aparición de falsos positivos (Kosaki et al., 2005).
Amplificación PCR
La optimización de las condiciones PCR es necesaria tanto para la obtención del suficiente producto de amplificado, como para evitar amplificaciones inespecíficas.
En líneas generales señalar que, cromatogramas de intensidades inferiores a 2 mv son difíciles de interpretar. Así mismo, la utilización de un único protocolo de PCR para la amplificación de diferentes secuencias de ADN favorece la automatización de los análisis por DHPLC.
La amplificación de las secuencias acotadas por parejas de cebadores que cumplan los requerimientos anteriormente descritos, se puede llevar a cabo mediante el protocolo de PCR descrito a continuación:
1. Desnaturalización inicial durante 4 min a 95 ºC.
2.
Amplificación mediante 30 ciclos de (30 s a 95 ºC, 30 s a 62 ºC y 90 s a 72
ºC).
3. Extensión final de 7 min a 72 ºC.
El uso conjunto de este protocolo de PCR con concentraciones de cebadores de 5 µM, sobre 10 ng de ADN molde, permite la obtención de productos de amplificación en cantidad suficiente para su análisis por DHPLC.
Del mismo modo, se recomienda la utilización de polimerasas de elevada efectividad para evitar la aparición de falsos positivos debidos a errores de la polimerasa durante la amplificación PCR (Kosaki et al., 2005).
Heteroduplexización
La heteroduplexización permite la formación de heteroduplex entre aquellos amplicones que presenten desapareamientos debido a una variación de tipo SNP en su secuencia.
Se realiza mediante:
1. Desnaturalización inicial a 96 ºC durante 5 min.
2. Renaturalización gradual mediante 69 ciclos de 22 seg (-1ºC después de cada ciclo).
Así mismo señalar que, aunque los productos de amplificado heteroduplexizados puedan conservarse durante varios días a 4 ºC, conviene disminuir en la medida de lo posible el tiempo transcurrido entre la heteroduplexización y el análisis del amplicón por DHPLC. En este sentido, se recomienda añadir la heteroduplexización al protocolo de PCR.
Análisis del amplicón por DHPLC
La tecnología DHPLC requiere de la utilización de muestras de referencia, así como de una precisa calibración y correcto funcionamiento del equipo para garantizar la sensibilidad y reproducibilidad de los resultados obtenidos. En el Anexo 1 se incluye un resumen detallado de los problemas frecuentes que se presentan cuando se trabaja con la tecnología DHPLC, así como las posibles causas y soluciones.
Por otro lado, la puesta a punto de los diferentes métodos de análisis consiste principalmente en la determinación de la temperatura óptima para la obtención de un elevado número de cromatogramas y su correcta interpretación.
Calibración del equipo
La calibración del DHPLC asegura la sensibilidad y reproducibilidad de los resultados obtenidos, para lo que es imprescindible garantizar el correcto calibrado del horno, ya que la detección de variaciones de tipo SNPs se produce a temperaturas específicas.
En este sentido cabe señalar que, los controles internos comerciales Mutation Standard (Transgenomic, Glasgow, UK) permiten calibrar el horno, así como comprobar el adecuado funcionamiento del WAVE System, el cual depende a su vez, del buen estado de la columna, de los tampones de trabajo, de la temperatura ambiental, así como de la ausencia de burbujas, obstrucciones y fugas (Schollen et al., 2005).
Factores que comprometen la resolución de los análisis por DHPLC
Variaciones en cualquiera de los siguientes factores pueden provocar la pérdida parcial o total de la resolución del DHPLC:
1.Temperatura ambiental: puede estar comprendida entre 18 - 25 ºC, pero ha de mantenerse constante. Variaciones de más de 2 ºC en la temperatura de la sala durante los análisis pueden reducir la fiabilidad de los resultados.
2.Presencia de burbujas, obstrucciones y fugas en el aparato: las burbujas pueden eliminarse en el mantenimiento diario y son fácilmente distinguibles visualmente. La presencia de obstrucciones o fugas se detecta por un aumento o descenso exagerado de la presión, respectivamente. Se recomienda la ayuda del servicio técnico para la localización y solución de estas anomalías.
3.Estado de la columna: el deterioro de la columna se caracteriza por un descenso en la altura de los picos obtenidos.
4.Estado de los tampones: además de verificar la fecha de caducidad, es importante utilizar tampones que no lleven más de un mes abiertos, así como revisar la integridad del filtro de cada uno de los tampones.
El blanco
El blanco consiste en programar una inyección de volumen 0 que nos permita observar la calidad de la línea base del cromatograma en ausencia de ADN. Conviene realizar un par de “blancos” cada vez que se cambie la temperatura del horno, para así evitar cromatogramas anómalos en las primeras muestras analizadas.
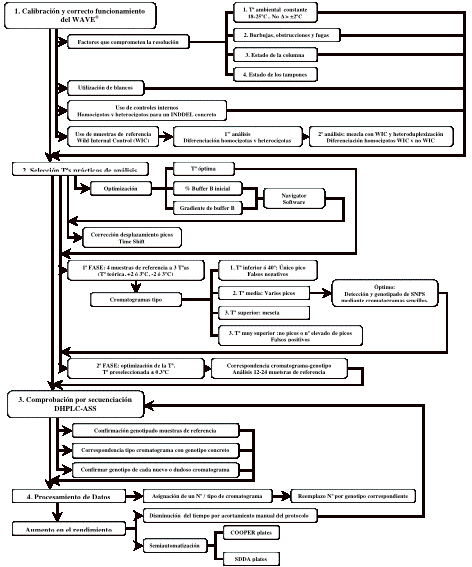
Figura 5. Resumen de la estrategia planteada para el Análisis de amplicones por
DHPLC.
Figure 5. Results of the analysis of all the amplicon (A) and optimal amplicon (B) obtained with the DNA Page application of the Navigator Software V.2.0.0 in the different panels (1-4).
Otros controles internos
Una vez calibrado el aparato, conviene comprobarlo periódicamente mediante el análisis de controles internos. Los controles internos comerciales resultan caros, por lo que conviene restringir su uso a la calibración del horno.
Una alternativa a su uso, es la utilización de aquellas muestras que ofrezcan un cromatograma previamente conocido, de tal forma que pueda correlacionarse con un genotipo tras su análisis por DHPLC. Siempre que sea posible, se recomienda el uso secuencial de dos tipos de controles internos correspondientes a muestras homocigotas y heterocigotas, respectivamente.
Del mismo modo, se recomienda la calibración mediante control interno:
1. Después de realizar el mantenimiento diario.
2. Tras recambiar cualquier componente del sistema.
3. Siempre que se sospeche una pérdida de resolución u otros problemas.
4. Cada 48 - 96 muestras analizadas.
Muestras de referencia
El genotipado de SNPs mediante DHPLC requiere de la comparación entre los cromatogramas de las muestras problema y los de las muestras de referencia de genotipo conocido. Se recomienda el empleo de una muestra de referencia por cada tipo de cromatograma que pueda obtenerse en dicho ensayo. Esto es, en el genotipado de un único SNP, se utilizarán dos muestras de referencia: una muestra homocigota para el alelo más frecuente del SNP en la población, denominada Wild Internal Control (WIC) y otra heterocigota para dicho SNP.
El genotipado de las muestras problema se realizará mediante dos análisis. El primero de ellos, permitirá la distinción entre homocigotos y heterocigotos para el polimorfismo analizado, mientras que para establecer la diferenciación entre los dos tipos de homocigotos es necesario un segundo análisis, en el que se proceda a mezclar cada una de las muestras problema homocigotas con la muestra WIC y su posterior heteroduplexización.
El análisis por DHPLC de estas mezclas produce dos tipos de cromatogramas, de tal forma que, aquellas mezclas que contengan muestras problema homocigotas para el mismo alelo que la muestra WIC, darán lugar a un cromatograma idéntico al de dicha muestra.
Mientras que, en el análisis de las muestras problema homocigotas para un alelo distinto al de la muestra WIC, se obtendrán cromatogramas idénticos al de la muestra heterocigota de referencia.
La existencia de cromatogramas distintos a los generados por el análisis de las muestras de referencia, revelará la presencia de variaciones diferentes a las previstas en el amplicón, de tal modo que éstas podrán ser identificadas por secuenciación directa.
Cabe señalar que, bien antes de analizar las muestras problema o bien cada 48 – 96 muestras analizadas, es recomendable el análisis de ambos tipos de muestras de referencia. Por último destacar que, dichas muestras de referencia pueden ser utilizadas como controles internos.
Selección de temperaturas prácticas de análisis
La optimización de métodos de análisis por DHPLC, requiere de la correcta determinación de la temperatura práctica, así como del gradiente de tampón B a lo largo del análisis.
El programa Navigator Software permite automatizar en gran parte las variables concernientes al gradiente de tampón B, ya que proporciona un método de análisis en base a la composición nucleotídica y la longitud del amplicón.
Por otro lado, la previa selección de la temperatura teórica (ver. “3. selección de temperaturas teóricas de análisis”), permite determinar el rango de temperatura de 1 – 3 ºC, en el que del 50 – 90% del amplicón de interés se encuentra en forma helicoidal.
La temperatura práctica puede determinarse a través del análisis de 4 muestras de referencia (2 homocigotas y 2 heterocigotas para el polimorfismo de interés) a 3 temperaturas diferentes, de modo que dichas temperaturas se correspondan con la temperatura teórica, con una temperatura 2 - 3 ºC por debajo y con otra 2 - 3 ºC por encima de ella.
Corrección del desplazamiento de los picos
El método inicial generado por el programa Navigator Software tiene una duración estándar de 7.5 min, de tal forma que la señal correspondiente a las especies moleculares presentes en el amplicón analizado, se observan a tiempos de unos 4 minutos, aproximadamente.
El incremento en la temperatura de análisis acelera la elución de los amplicones a lo largo de la columna, por ello cabe reseñar que en una elución demasiado temprana de los mismos, su señal puede quedar enmascarada por la correspondiente al pico de inyección, ya que es detectada en tiempos menores a 2 minutos, tal y como se observa en la figura 2.
Este fenómeno puede ser corregido mediante la introducción de valores positivos o negativos en la opción “time shift” del programa Navigator Software.
En líneas generales, un valor de time shift = +1 genera un cambio en el porcentaje de tampón B inicial, que a su vez provoca un retraso de un minuto en la elución de las moléculas a través de la columna, respecto al método de análisis propuesto inicialmente por el programa. La opción time shift no altera la duración total del método de análisis.
Cromatogramas tipo
El estudio del comportamiento del amplicón de interés en un rango de 4 a 6 ºC, facilita la elección de la temperatura óptima de análisis.
Si el rango de temperatura seleccionado es el adecuado, habitualmente se observan cromatogramas que comparten ciertos caracteres comunes entre los diferentes amplicones.
A continuación se describe una serie de cromatogramas tipo, con el fin de proporcionar unas indicaciones generales para su interpretación. Estas descripciones se corresponden con los cromatogramas tipo obtenidos en el análisis de un mismo amplicón a diferentes temperaturas (Figura 6):
1. A la temperatura del extremo inferior del rango se observa un único pico (ó a 40ºC): correspondiente al 100% de las moléculas en forma de doble hebra (Figura 6A).
2. A temperaturas medias se observan varios picos: correspondientes a las diferentes especies moleculares ó bien a los diferentes estados de desnaturalización de una única especie molecular (figuras 6B y 6C).
3. A temperaturas mayores es habitual observar una
agrupación de diferentes picos en una meseta: No confundir con el cromatograma
correspondiente al caso 1 (Figura 6C).
4. A temperaturas aún mayores no se observan picos: debido ello a que el amplicón eluye por la columna en el primer minuto y su señal se confunde con la correspondiente al pico de inyección. En determinadas ocasiones, a un rango de temperaturas superiores se observan cromatogramas tipo 3, con un elevado número de picos de intensidad similar.
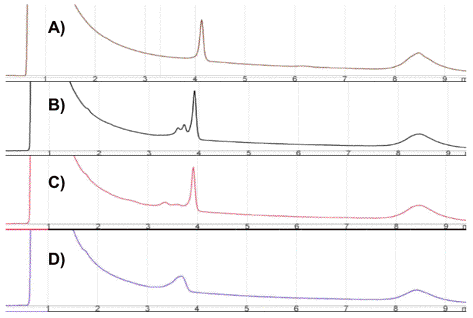
Figura 6. Cromatogramas tipo (A: tipo 1, B y C: tipo 2 y D: tipo 3)
correspondientes al análisis de un amplicón a diferentes temperaturas.
Figure 6. Standard chromatograms (A: type 1, B and C: type 2 and D: type 3) corresponding to the analysis of one amplicon at different temperatures.
Un método de análisis debidamente optimizado es aquel que permite la detección y genotipado de variaciones de tipo SNPs, mediante cromatogramas que sean fácilmente distinguibles.
En general, resulta más sencillo establecer diferencias y similitudes, entre amplicones con diferentes genotipos, en el rango de temperaturas que ofrezcan cromatogramas tipo 2 o similares (Figuras 6B y 6C).
Una segunda fase, en las que las que se testen temperaturas que difieran en un rango de 0.5ºC respecto a las temperaturas preseleccionadas, favorece la determinación de las temperaturas de análisis más resolutivas.
Así mismo y como pre-validación del método, se recomienda la comprobación de la correspondencia ente cromatogramas y genotipos determinados por secuenciación directa, en 12 – 24 muestras de referencia, antes de proceder al análisis de un elevado número de muestras problema.
Selección de temperatura de análisis en ausencia de muestras de referencia
El análisis por DHPLC destinado a la búsqueda de nuevas variaciones de tipo SNPs, presenta la dificultad añadida de la no disposición de muestras de referencia para los genotipos heterocigotos.
En estos casos, es de vital importancia la búsqueda de temperaturas de análisis que permitan trabajar con cromatogramas de un número reducido de picos. De modo que, al no disponerse de muestras de referencia heterocigotas para su comparación con las muestras problema, debe ponerse especial atención en establecer diferencias entre los cromatogramas proporcionados por la muestra de referencia homocigota y las diferentes muestras problemas, para evitar así la aparición de falsos negativos ó positivos.
Falsos negativos: el análisis a temperaturas menores que la óptima (Figura 6, cromatograma tipo 1), no permite la separación por DHPLC de las diferentes especies moleculares presentes en la muestra.
Falsos positivos: el análisis a temperaturas superiores a la óptima (Figura 6, cromatogramas tipo 3 y 4), puede ofrecer cromatogramas que aparentemente contengan diferentes especies moleculares, cuando en realidad los diferentes picos se corresponden con una única especie molecular en diferentes grados de desnaturalización.
Comprobación por secuenciación directa ¿Qué secuenciar?
Una de las principales ventajas del binomio DHPLC-AAS en la búsqueda y genotipado de SNPs, es la reducción de coste que supone con respecto al uso único de la secuenciación directa. En este sentido cabe señalar que, resulta imprescindible secuenciar parte de las muestras analizadas por DHPLC.
Ahora bien, debido a su elevado coste conviene delimitar al mínimo el número de muestras a secuenciar para poder determinar o confirmar el genotipo correspondiente a cada tipo de cromatograma.
Procesamiento de datos
Los cromatogramas resultantes del análisis por DHPLC pueden ser procesados a través del programa Navigator Software, que oferta la posibilidad de exportar los mismos en formato pdf.
De tal forma que, el procesamiento de datos puede realizarse mediante la numeración de cada tipo de cromatograma.
Esta metodología es de especial interés en los casos en los que el análisis de un único amplicón de lugar a un elevado número de cromatogramas, así como en aquellos en que varios tipos de cromatogramas se correspondan con un mismo genotipo.
Aumento del rendimiento del análisis por DHPLC-AAS
A continuación se proponen dos metodologías para aumentar el rendimiento del binomio DHPLC-AAS. La primera consiste en la reducción del tiempo de análisis de cada amplicón y la segunda, basada en el uso de Simple Dryed DHPLC Analisis (SDDA), facilita la semiautomatización de la amplificación PCR de aquellos ensayos destinados a investigación.
Reducción del tiempo de análisis por DHPLC
La tecnología Transgenomic WAVE System 4500 con una columna DNAsep Cartridge (Transgenomics, Glasgow, UK) proporciona la opción de analizar los amplicones en el método “Rapid DNA” en tiempos inferiores a 7.5 minutos. No obstante, al ser su resolución algo menor a la del análisis habitual, puede dificultar la interpretación de los cromatogramas.
Existe una alternativa relativamente sencilla al Rapid DNA, a partir del método de análisis proporcionado por Navigator Software. Por un lado, mediante la introducción de valores negativos en la herramienta time shift, puede acelerarse la detección de los picos de interés a tiempos de 2 a 3 minutos. Posteriormente, puede eliminarse el tiempo sobrante de análisis, mediante la supresión del gradiente de % de tampón B correspondiente a ese lapso de tiempo.
Esta metodología ha permitido el diseño de nuevos ensayos de idéntica resolución a los iniciales, con duraciones que oscilan en el rango 2.5 – 3.5 min por muestra, lo que supone una reducción del tiempo de análisis de entre 8 y 6 horas por 96 muestras analizadas.
Sample Dryed DHPLC Analisis (SDDA)
El diagnóstico clínico y la investigación mediante DHPLC, presentan diferentes requerimientos y por tanto las metodologías destinadas a la automatización de los análisis son diferentes en ambos casos.
El diagnóstico clínico por DHPLC habitualmente requiere el análisis de varios amplicones en un número reducido de individuos, con el fin de genotipar varios SNPs de interés y poder asociarlos a una determinada patología. En estos casos resulta de gran interés la utilización de Condition-Oriented-PCR-primer-Embedded-Reactor plates (COOPER plates), ya que favorece la automatización de los análisis (Kosaki et al., 2005).
Dicha metodología consiste en utilizar placas con cebadores deshidratados, para la amplificación simultánea de multitud de amplicones y su posterior análisis por DHPLC. Por lo que, ha sido utilizada en el estudio de SNPs relacionados con los síndromes Marfan, CHARGE, Lange, Sotos y Rbistein-Taybi. (Kosaki et al., 2005).
Por el contrario, la investigación mediante DHPLC habitualmente persigue estudiar diferentes regiones del ADN en un elevado número de individuos. En estos casos las COOPER plates no ofrecen ventajas de automatización debido principalmente al elevado número de muestras a analizar.
En este sentido, se ha desarrollado la metodología Simple Dryed DHPLC Analisis (SDDA), para favorecer los análisis por DHPLC destinados a la investigación. Dicha metodología consiste en la distribución en placas madre de 96 pocillos, de los extractos de ADN correspondientes a diferentes individuos, en cantidad suficiente para la realización de varios ensayos. De este modo, se facilita la distribución de la cantidad de ADN necesario para un único análisis en placas de uso, que son posteriormente deshidratadas y conservadas a -20 ºC. Por lo tanto, el uso de placas SDDA, favorece la semiautomatización de la amplificación PCR en un elevado número de muestras.
Discusión
La tecnología DHPLC es una herramienta sensible y específica para la búsqueda y genotipado de variaciones de tipo SNPs (Yu et al., 2006), si bien el diseño de sus métodos presenta cierta complejidad, debida principalmente a los requerimientos termodinámicos de los amplicones a analizar y a las condiciones específicas de cada método de análisis. En este sentido señalar que, la aplicación de pautas globales para la estandarización de los métodos de análisis por DHPLC-AAS supone una reducción de esfuerzo, tiempo y dinero (Kosaki et al., 2005), así como un incremento en la fiabilidad de los resultados obtenidos. Los procesos previos al análisis por DHPLC de los diferentes amplicones son susceptibles de automatización, sin embargo los ensayos por DHPLC resultan muy difíciles de estandarizar, puesto que el análisis de cada amplicón y en ocasiones la detección de cada variación tipo SNP, se realiza en unas condiciones muy específicas.
Las metodologías presentadas en este estudio pueden favorecen la estandarización y automatización de métodos de análisis por DHPLC, mediante la utilización de idénticas condiciones de PCR en todos los casos, de manera que se simplifique el análisis de diversas regiones en un elevado número de muestras. De este modo, es posible alcanzar un rendimiento aproximado de 2 placas de 96 pocillos por día, en un proceso semiautomatizado.
La aplicación de estas metodologías al descubrimiento de SNPs, presenta ventajas respecto al uso exclusivo de la secuenciación directa (Hering et al., 2008), principalmente debidas al aumento de rendimiento en el número de muestras analizadas por día, al menor tiempo invertido en el procesamiento de los resultados y al coste aproximado de 1€ / muestra, en comparación con los 6 € / muestra de la secuenciación directa.
Así mismo destacar que, recientemente el uso del binomio DHPLC-AAS combinado con el corte por enzimas de restricción, ha permitido además del genotipado de SNPs, el análisis de las fases de ligamiento de haplotipos formados por loci STRs y SNPs de regiones flanqueantes (SNPSTRs), lo que resulta de gran utilidad en la resolución de parentescos complejos (Odriozola et al., 2009), en los que es necesario determinar si aquellos alelos compartidos por el supuesto padre e hijo, son iguales por descendencia o por estado. Del mismo modo, recientes estudios de regiones flanqueantes de loci STRs mediante pirosecuenciación, se muestran prometedores tanto en el descubrimiento de SNPs de regiones flanqueantes, como en el genotipado de loci STRs (Divne et al.,, 2010).
No obstante cabe señalar también que la correspondencia entre cromatograma y genotipo por DHPLC-AAS, se ve dificultada por la presencia en un mismo amplicón de más de 2 posiciones de tipo SNPs que se muestren polimórficas en las muestras analizadas. Por lo que, para estos casos se aconseja el uso de otras técnicas más apropiadas como SNaPShot (Sanchez et al., 2003; Quintans et al., 2004) ó SNPlex (Nilsson et al., 1994), capaces de genotipar entre 12-48 SNPs en modo multiplex. Así mismo, el uso de la secuenciación directa puede ser de interés en el genotipado de amplicones que contengan un elevado número de SNPs, ya que en estos casos su coste por polimorfismo analizado se ve notablemente reducido.
A modo de resumen decir que, las pautas globales combinadas con el empleo de placas SDDA y con la reducción del tiempo de análisis por DHPLC, se muestran altamente eficaces en la estandarización de la búsqueda de variaciones de tipo SNPs por DHPLC-ASS en un amplio rango de amplicones, así como también en el genotipado de aquellas regiones que no contengan más de 2 de estos polimorfismos.
Referencias
Balogh, K., et al., 2004, Genetic screening methods for the detection of mutations responsible for multiple endocrine neoplasia type 1. Mol Genet Metab. 83(1-2), 74-81.
Danielson, P.B., et al., 2007, Resolving mtDNA mixtures by denaturing high-performance liquid chromatography and linkage phase determination. Forensic Sci Int Genet. 1(2), 148-53.
Devaney, J.M., J.E. Girard, and M.A. Marino, 2000, DNA microsatellite analysis using ion-pair reversed-phase high-performance liquid chromatography. Anal Chem. 72(4), 858-64
Divne, A.M., H. Edlund, and M. Allen, 2010, Forensic analysis of autosomal STR markers using Pyrosequencing. Forensic Sci Int Genet. 4(2), 122-9.
Frueh, F.W. and M. Noyer-Weidner, 2003, The use of denaturing high-performance liquid chromatography (DHPLC) for the analysis of genetic variations: impact for diagnostics and pharmacogenetics. Clin Chem Lab Med. 41(4), 452-61.
Hansen, T.V., et al., 2008, Novel de novo BRCA2 mutation in a patient with a family history of breast cancer. BMC Med Genet. 9, 58.
Hegde, M.R. and B.B. Roa, 2006, Detecting mutations in the APC gene in familial adenomatous polyposis (FAP). Curr Protoc Hum Genet. Chapter 10: p. Unit 10 8.
Hering, S., et al., 2008, Complex variability of intron 40 of the von Willebrand factor (vWF) gene. Int J Legal Med. 122(1), 67-71.
Hou, Y. and S. Zhang, 2000, Temperature-modulated high-performance liquid chromatography for detecting variation in human genome. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 17(3), 145-8.
Jiang, Q.C., et al., 2006, [Genetics of heteroplasmy in the mtDNA control region among the Chinese Han population]. Fa Yi Xue Za Zhi. 22(3), 198-203.
Kosaki, K., T. Udaka, and T. Okuyama, 2005, DHPLC in clinical molecular diagnostic services. Mol Genet Metab. 86(1-2), 117-23.
Kwok, P.Y. and X. Chen, 2003, Detection of single nucleotide polymorphisms. Curr Issues Mol Biol. 5(2), 43-60.
Lilleberg, S.L., 2003, In-depth mutation and SNP discovery using DHPLC gene scanning. Curr Opin Drug Discov Devel. 6(2) 237-52.
Liu, J.X., et al., 2008, Association of sterol regulatory element-binding protein-1c gene polymorphism with type 2 diabetes mellitus, insulin resistance and blood lipid levels in Chinese population. Diabetes Res Clin Pract. 82(1), 42-7.
Nilsson, M., et al., 1994, Padlock probes: circularizing oligonucleotides for localized DNA detection. Science. 265(5181), 2085-8.
Ning, Y., et al., 2008, Polymorphisms of aquaporin5 gene in chronic obstructive pulmonary disease in a Chinese population. Swiss Med Wkly. 138(39-40), 573-8.
Odriozola, A., et al., 2009, SNPSTR rs59186128_D7S820 polymorphism distribution in European Caucasoid, Hispanic, and Afro-American populations. Int J Legal Med. 123(6), 527-33.
Quintans, B., et al., 2004, Typing of mitochondrial DNA coding region SNPs of forensic and anthropological interest using SNaPshot minisequencing. Forensic Sci Int. 140(2-3), 251-7.
Sanchez, J.J., et al., 2003, Multiplex PCR and minisequencing of SNPs--a model with 35 Y chromosome SNPs. Forensic Sci Int. 137(1), 74-84.
SantaLucia, J., 1998, A unified view of polymer, dumbbell, and oligonucleotide DNA nearest-neighbor thermodynamics. Proc Natl Acad Sci U S A. 95(4), 1460-5.
Schollen, E., et al., 2005, Diagnostic DHPLC Quality Assurance (DDQA): a collaborative approach to the generation of validated and standardized methods for DHPLC-based mutation screening in clinical genetics laboratories. Hum Mutat. 25(6), 583-92.
Shi, M., et al., 2007, 6 Y-SNP typing of China and Korean samples using primer extension and DHPLC. J Forensic Sci. 52(1), 235-6.
Soejima, M. and Y. Koda, 2005, Denaturing high-performance liquid chromatography-based genotyping and genetic variation of FUT2 in Sri Lanka. Transfusion. 45(12), 1934-9.
Tian, H. and S.Y. Zhou, 2008, [Polymorphisms in the breakpoint cluster region of bcr gene]. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 16(3), 659-62.
Transgenomic, 2003-2005, TRANSGENOMIC, transforming the world, WAVE System 4500 User Guide. inc. 482057-00.
Underhill, P.A., et al., 1997, Detection of numerous Y chromosome biallelic polymorphisms by denaturing high-performance liquid chromatography. Genome Res. 7(10),996-1005.
Wirtz, M.K., et al., 2007, Clinical features associated with an Asp380His Myocilin mutation in a US family with primary open-angle glaucoma. Am J Ophthalmol. 144(1), 75-80.
Wurzburger, R.J., et al., 2003, Use of GC clamps in DHPLC mutation scanning. Clin Med Res. 1(2), 111-8.
Xiao, W. and P.J. Oefner, 2001, Denaturing high-performance liquid chromatography: A review. Hum Mutat. 17(6), 439-74.
Xie, Y., et al., 2004 [The haplotypes of three single nucleotide polymorphisms in caspase-3 gene in Han nationality of Zhejiang province in China.]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 21(6), 633-5.
Ye, Y.F., et al., 2006 a, [Haplotypes of four single nucleotide polymorphisms in caspase-8, -10 genes in Han nationality of Zhejiang province in China]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 23(2), 222-6.
Ye, Y.F., et al., 2006b, A novel microsatellite within intron 8 in caspase10 gene in Chinese of Han nationality. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 23(1), 16-8.
Yu, B., et al., 2006, DNA mutation detection using denaturing high-performance liquid chromatography (DHPLC). Curr Protoc Hum Genet. Chapter 7: p. Unit7 10.
|
Error/ problema |
Posibles causas |
Soluciones |
|
Aumento presión |
Cristalización de TEAA en zonas críticas del sistema |
Revisión completa del circuito, haciendo hincapié
sobre todo en zonas de unión entre capilares que conectan las diferentes
partes del sistema con el fin de situar la parte o zona obstruida y actuar en
consideración. Intentar limpiar
el sistema con un hot-wash. Si no es suficiente con esto limpiar y/o
sustituir la zona obstruida. |
|
Burbujas de Aire en el sistema |
Purga del sistema (mantenimiento) |
|
|
Prefiltro obturado |
Cambio del prefiltro por uno nuevo |
|
|
Columna deteriorada |
Probar la restauración de la columna aplicándole un
hot-wash. Si no es suficiente probar invirtiendo la dirección de la columna
para eliminar la suciedad de esta y utilizarla en esta nueva dirección para
el resto de vida útil de la misma. Si aún así no disminuye la presión,
reemplazar la columna. |
|
|
Disminución presión |
Fuga de volumen en zonas críticas del sistema |
Revisar todo el sistema en busca de la posible fuga.
Las pérdidas suelen ocurrir en la jeringa de inyección, zonas de unión de los
tubos y columna. Ajustar las uniones y en caso de ser necesario reemplazar
las piezas necasarias |
|
Buffers agotados |
Reemplazar por buffers nuevos |
|
|
Columna rota |
Reemplazar columna |
|
|
Detector de gases detecta un pico |
Fuga de volumen en zonas críticas del sistema |
Revisar todo el sistema en busca de la posible fuga.
Las pérdidas suelen ocurrir en la jeringa de inyección, zonas de unión de los
tubos y columna. Ajustar las uniones y en caso de ser necesario reemplazar
las piezas necesarias |
|
Presencia de algún disolvente orgánico volátil en el
ambiente |
Airear la zona y eliminar todos los reactivos que
puedan estar aportando dichos volátiles al ambiente |
|
|
Bidón de residuos desbordado o no aislado
correctamente |
Revisar y/o reemplazar el bidón de residuos |
|
|
Disminución e incluso pérdida en la resolución |
Columna saturada o deteriorada |
Probar la restauración de la columna aplicándole un
hot-wash. Si no es suficiente probar invirtiendo la dirección de la columna
para eliminar la suciedad de esta y utilizarla en esta nueva dirección para
el resto de vida útil de la misma. Si aún así no se mejora la resolución (no
permite detectar los mutation standars) reemplazar la columna |
|
Buffers caducados |
Reemplazar los buffers y comprobar la resolución con
los mutation Standards |
|
|
Variación de la Tª ambiental |
Calibrar el horno con la nueva temperatura ambiental
si es que esta es constante y comprobar la resolución con los mutation
standards. Si la temperatura ambiental no es constante será muy difícil
obtener resultados fiables, por ello es un requisito casi indispensable |
|
|
Descalibración del horno |
Calibrar el horno y comprobar la resolución con los
mutation standards |
|
|
Pérdida de la comunicación entre el ordenador y
el equipo |
Algún cable ha perdido su unión |
Revisar las uniones en el cableado entre el DHPLC y
el ordenador |
|
Sobrecarga de información u ordenes al sistema |
En la pantalla “Queue” seleccionar tres veces la
opción “Flush the Queue” paraeliminar la cola de órdenes enviadas al
sistema. Enviarle nuevas órdenes
y comprobar la comunicación. Si esto no es suficiente apagar el navigator
software y comprobar la conexión en el “Maintenance Software” si no hay
conexión con alguna parte del sistema reiniciar el equipo y el ordenador y
volver comprobar las conexiones |
|
|
Pérdida de la comunicación entre el ordenador y
el módulo detector de UV |
Sobrecarga de información u ordenes al sistema |
En la pantalla “Queue” seleccionar tres veces la
opción “Flush the Queue” para eliminar la cola de órdenes enviadas al
sistema. Comprobar la
comunicación con el módulo UV. Si esto no es suficiente apagar el navigator
software y comprobar la conexión en el “Maintenance Software” si no hay
conexión con el módulo UV reiniciar el equipo y el ordenador y volver comprobar la conexión |
|
Algún cable ha perdido su unión |
Revisar las uniones en el cableado entre el módulo
UV del DHPLC y el ordenador |
|
|
Lampara UV fundida |
Reponer la lampara UV |
|
|
Equipo ralentizado |
Sobrecarga de información u ordenes al sistema |
En la pantalla “Queue” seleccionar tres veces la
opción “Flush the Queue” para eliminar la cola de órdenes enviadas al
sistema. Enviarle nuevas órdenes
y comprobar la comunicación. Si esto no es viable apagar el navigator
software y comprobar la conexión en el “Maintenance Software” si no hay conexión
con alguna parte del sistema reiniciar el equipo y el ordenador y volver comprobar las conexiones y velocidad |
|
Versión desactualizada del software |
Descargar
las nuevas versiones existentes del sofware de la página web de Transgenomic (http://www.transgenomic.com/sp/sw/nav/2p2p0/Software220.asp).
Instalar las actualizaciones necesarias desde la más antigua a la más
reciente (es necesario tener instaladas las versiones anteriores para que la
más reciente funcione correctamente) |
|
|
Queue activa |
Cerrar "Queue" |
Anexo. Problemas o errores frecuentes en el análisis por DHPLC así como sus
posibles causas y soluciones.
Annex. Common problems and errors derived from the analysis by DHPLC, as well as possible causes and solutions.