
Paluku They-They,
T., Hamzi, K., Mazabraud, A., Nadifi, S., 2009, Fréquence du polymorphisme C677T du gène de la méthylène tetrahydrofolate réductase
(MTHFR) dans les populations arabe et berbère du Maroc. Antropo, 20, 11-17. www.didac.ehu.es/antropo
Fréquence du polymorphisme C677T du gène
de la méthylène tetrahydrofolate
réductase (MTHFR) dans les populations arabe et berbère du Maroc
Frequency of C677T
polymorphism of methylene tetrahyrofolate
reductase (MTHFR) gene among berber and arabic Moroccan populations
Thierry
Paluku They-They1, Khalil Hamzi1, André Mazabraud2,
Sellama Nadifi1
1 Laboratoire de Génétique Médicale
et Pathologie Moléculaire (LGPM), Faculté de Médecine et de Pharmacie-
Casablanca; 19, rue Tarik- Ibn- Ziad, B.P. 9154, 10 000 Casablanca, Maroc.
2 Laboratoire de Transgénèse et Génétique des Amphibiens, PARIS-SUD
Auteur chargé de la
correspondance:
They-They Paluku Thierry, Laboratoire de Génétique Médicale et Pathologie
Moléculaire (LGPM), Faculté de Médecine et de Pharmacie- Casablanca; 19, rue
Tarik- Ibn- Ziad, B.P. 9154, 10 000 Casablanca, Maroc. E-mail: thierrypal@yahoo.fr
Mots clés: Polymorphisme C677T MTHFR, Population marocaine Arabe et berbère, Génotypage
Key words: Arab and Berber
Moroccan Populations, C677T MTHFR Polymorphism, Genotype
Résumé
La distribution du génotype C677T MTHFR est variable et hétérogène selon les zones géographiques et les ethnies. La caractéristique principale de la population Marocaine est sa diversité ethnique. En revanche, des études génétiques sur cette population sont très limitées. Notre objectif était de déterminer la fréquence du polymorphisme C677T MTHFR dans la population marocaine. L’étude a concerné 182 sujets marocains en bonne santé apparente et provenant de deux ethnies majoritaires Arabes et Berbères. Nos résultats ont révélé que la distribution des génotypes du polymorphisme C677T MTHFR était en équilibre avec la loi de Hardy-Weinberg avec une fréquence de l’homozygotie TT estimée à 6 % et celle de l’allèle T à 26,4%. Aucune différence statistique significative n’a été observée entre les deux populations Arabes et Berbères. Cette fréquence reste intermédiaire entre la population occidentale et la population sub-saharienne.
Abstract
Recent studies showing that the frequency of C677T differs widely among
areas and ethnic populations. The feature of the Moroccan population is its
ethnic diversity. However, studies for Moroccan populations are limited. The
aim of this study was to assess the frequency of C677T MTHFR polymorphism in
the Moroccan population to further facilitate investigations on the possible
associations with various pathologies. The study concerned 182 peoples
apparently healthy and randomly selected in Arabs and Berbers Moroccan
individuals. No statistical differences in the frequency of mutant homozygote
were found in Arabs and Berbers groups. T allelic frequency was found to be
26.4% and the TT homozygous genotype frequency of 6 % in the Moroccan
population which was in Hardy-Weinberg equilibrium. The C677T MTHFR
polymorphism distribution in the Moroccan population remains intermediate
between Western and sub-Saharan population.
Introduction
La 5,10- Méthylène tétrahydrofolate réductase, MTHFR est une enzyme importante qui catalyse, de façon irréversible la conversion de 5,10-méthylène tétrahydrofolate en 5- méthylène tétrahydrofolate, un substrat clé donneur de folate et de carbone pour la reméthylation de l’homocystéine en méthionine (Scott, 1981). Cette enzyme est codée par le gène MTHFR localisé sur le bras court du chromosome 1 dans la région 1p36.3 (Goyette et al., 1998).
Plusieurs mutations ont été identifiées sur ce gène dont un polymorphisme C677T plus commun, caractérisé par une transition du nucléotide cytosine par la thymine en position 677, il s’ensuit une substitution du résidu alanine par la valine en position 222 (A222V) (Frosst et al.,1995). Cette mutation, à l’état homozygote ou hétérozygote est corrélée avec une réduction de 50% de l’activité enzymatique et une augmentation de sa thermolabilité ( Frosst et al.,1995; Selzer et al, 2003). Les individus homozygotes pour cette mutation ont une élévation très significative de la concentration de l’homocystéine plasmatique (Frosst et al.1995), associée à une baisse du taux des folates ( Kauwell et al, 2000; Cheryl L, 2003). En revanche, des taux élevés en folates plasmatiques semblent neutraliser les effets dus à la mutation C677T MTHFR (Jacques et al, 1996). En plus, le polymorphisme MTHFR C677T influence l’état de méthylation du DNA génomique par l’entremise de son interaction avec le métabolisme des folates (Friso et al, 2002).
Sur le plan clinique, des études
épidémiologiques non confirmées voir parfois controversées, en fonction de la
population et de la région géographique, ont rapporté la corrélation de la
mutation C677T MTHFR avec plusieurs processus pathologiques (Ueland, 2001)
notamment ceux dépendants du
métabolisme des folates. Il s’agit de la schizophrénie ( Muntjewerff, JW et
al. 2005; Sazci, A et al. 2003a, 2005b); des maladies cardiovasculaires (Lewis, S.J et
al, 2005; Bennouar N et al,
2007); les cancers (Anvesha Srivastava et al,
2008); les anomalies de développement embryonnaire dont l’insuffisance de
fermeture du tube neural ( Botto, l et al. 2000).
Cependant, des résultats contradictoires ont été reportés ((Papapetrou, C. et al,
1996; Koch, M.C. et al, 1998; Botto,
L.D et al, 2000; Dilley, A. et al, 2001; Zhang, G. et al, 2001). Cette controverse a été partiellement expliquée
par des récentes études qui ont démontrées que la fréquence du polymorphisme
C677T du gène MTHFR diffère largement dans différentes populations en fonction
de l’aire géographique et des ethnies ((Virgos, C. et al, 1999; Wilcken, B. et al, 2003; Yu, L. et al,
2004; Muntjewerff, J.W., 2006).
Le Maroc est un pays du nord-ouest africain peuplé par une population d’origine caucasoïde qui s’étend de la péninsule ibérique au Maroc (Cavalli-Sforza, L.L. et al, 1994). La caractéristique principale de la population marocaine est sa diversité ethnique. Cette population est subdivisée en Arabes, berbères, Juifs et noirs sub-sahariens. La contribution des arabes et berbères dans la constitution du pool génétique marocaine est certes évidente. Néanmoins, peu d’études ont été menées sur les populations marocaines.
Le but de cette étude était de déterminer la fréquence de la mutation C677T MTHFR parmi la population marocaine en vue de la comparer à celles obtenues ailleurs.
Sujets et méthodes
Population d’étude
Le travail a concerné une population de 182 sujets sains, âgés de 18 à 55 ans recrutés dans les deux groupes majoritaires dont 94 arabes et 88 berbères pendant la période allant d’octobre 2007 à septembre 2008. Les échantillons de sang ont été collectés chez des donneurs de sang au centre de transfusion sanguine du CHU Ibn Rochd de Casablanca. Après un examen clinique et des tests biologiques de routine préalables à tout don de sang, et un consentement éclairé, 5ml de sang total ont été prélevés sur l’anticoagulant EDTA.
Etude du génotype C677T MTHFR
L’extraction de l’ADN génomique a été réalisée par la méthode au sel suivie de son dosage par spectrophotométrie (Genequant). La méthode PCR/RFLP inspirée des travaux de Frosst et al (1995) a permis la mise en évidence de la mutation C677T par l’amplification d’un fragment de 198 pb du gène MTHFR à l’aide des amorces suivantes: sens: 5’-TGAAGGAGAAGGTGTCTGCGGGA-3’ et antisens: 5’-GGACGGTGCGGTGAGAGTG- 3’dans un programme d’amplification suivant: une dénaturation initiale à 94°C pendant 10 minutes, suivie de 35 cycles comprenant chacun une dénaturation à 95°C pendant 1 minute, une hybridation à 62°C pendant 1 minutes et demie, une élongation à 72°C pendant une minute et une élongation finale à 72°C pendant 5 minutes dans un thermocycleur GeneAmp PCR System 9700 (Applied Biosystems). Les amplifiants ont subi une digestion enzymatique par l’enzyme de restriction HinfI à 37°C pendant 3 heures. Les produits de digestion ont été analysés par électrophorèse sur un gel d’agarose à 3% en présence d’un marqueur de poids moléculaire ladder 100. La révélation a été réalisée sous la lumière ultraviolette (UV) sur un transilluminateur après coloration au bromure d’éthidium. Le polymorphisme crée un site de restriction HinfI qui se traduit par la présence d’une bande digéré de 175 pb.
Analyse statistique
L’analyse statistique a été effectuée par le test de chi-deux qui a permis la comparaison de génotype et des fréquences alléliques avec d’autres populations. Pour examiner la conformité de la distribution du génotype par rapport à l’équilibre de HARDY-WEINBERG avec un risque d’erreur de 0.05, le logiciel CeCILL V2 a été utilisé.
Résultats
Le tableau 1
montre la distribution des génotypes et des fréquences alléliques des 182
sujets marocains Arabes et Berbères étudiés. La fréquence totale de l’allèle T
estimée égale à 26,3% pour les
deux populations arabes et berbères de notre étude. Les distributions des
génotypes du polymorphisme C677T du gène MTHFR dans ces deux populations sont
conforme à l’équilibre de Hardy-Weinberg (Chi-deux : 1,234, ddl : 1,
p-value: 0,26665 et chi-deux : 0,034, ddl : 1, p-value: 0,8537,
respectivement, pour les populations Arabes et Berbères). Il n’existe pas de
différence statistiquement significative entre la fréquence des mutants
homozygotes entre Arabes et Berbères, respectivement de 26,5 % et 26,1%.
La
figure 1 montre parmi le groupe arabe, 7 personnes ont été homozygotes T / T
(7,4%), 36 personnes hétérozygotes C / T (38,3%) et 51 étaient homozygotes pour
l'allèle sauvage C/C (54,3%). Pour les Berbères, 4 personnes sont homozygote T
/ T (4,5%), 38 personnes sont hétérozygotes C / T (43,2%), et 46 personnes sont
homozygotes pour l'allèle sauvage C/C (52,3%).
Le
tableau 2 montre les fréquences génotypiques et alléliques du polymorphisme C677T MTHFR dans la population
Marocaine étudiée comparées à
celles des autres populations dans le monde. Pour la comparaison de nos propres
données à celles de la littérature, le test chi-deux a été utilisé avec un
degré de liberté (ddl) égale à pour une probabilité à 0,05.
Le
profil électrophorétique de contrôle de digestion HinfI est repris dans la
figure 2 pour chacun de génotypes avec pour le génotype homozygote T / T, un
fragment d'ADN de 175pb, le génotype hétérozygote C / T, deux fragments d'ADN de 175pb et 198pb et le génotype homozygote de type
sauvage C / C, un fragment d'ADN non digéré de 198pb en présence d’un marqueur
de poids moléculaire M.
|
Groupes étudiés |
Génotypes C/C |
Génotypes C/T |
Génotypes T/T |
Allèle T |
HWE |
|
Arabes (n=94) |
51(54,3%) |
36(38,3%) |
7(7,4%) |
0,265 |
0,034* |
|
Berbères (n=88) |
46(52,3%) |
38(43,2%) |
4(4,5%) |
0,261 |
1,23** |
|
Total ( n =182) |
97(53,3%) |
74(40,7%) |
11(6%) |
|
|
Tableau 1. Distribution des génotypes C677T du gène MTHFR dans la population
Marocaine. *(Chi-deux=0,034; ddl=1; p-value=0,8537);**( Chi-deux=1,23; ddl=1;
p-value=0,8537); HWE:équilibre
Hardy-Weinberg; n = effectif
Table
1. C677T genotypes distribution in the Moroccan population
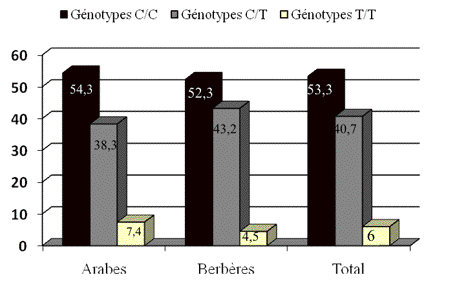
Figure 1. Histogramme des fréquences génotypiques et
alléliques C677T
MTHFR des deux populations Marocaines
Figure 1. C677T
MTHFR polymorphism allelic and genotype frequency in two Moroccan populations
|
Populations |
Nombres |
C/C(%) |
C/T(%) |
T/T(%) |
Allèle T |
Références |
|
Maroc |
182 |
97(53,3) |
74(40,7) |
11(6) |
0,263* |
Notre étude |
|
Maroc |
190 |
113(59,3) |
61(32,1) |
16(8,4) |
0,245* |
Bennouar, N. et al. |
|
Tunisie |
185 |
129(69,7) |
46(24,9) |
10(5,4) |
0,18 |
Jerbi Z. et al. |
|
Israël |
210 |
120(57) |
72(34) |
18(8,6) |
0,257 |
Wilcken et al. |
|
France |
178 |
72(40) |
85(48) |
21(11,8) |
0,357 |
Wilcken et al. |
|
Espagne |
601 |
265(44) |
265(44) |
71(11,8) |
0,339 |
Wilcken et al. |
|
Sub-sahara |
191 |
179(93) |
12(6,59) |
0(0,0) |
0,03 |
Chillemi et al. |
Tableau 2. Fréquence des génotypes C677T MTHFR dans différentes populations
*(Chi-deux=3,226; p<0,05; Pas de
différence statistiquement significative entre ces deux études)
Table
2. C677T MTHFR genotype among different human populations
Discussion
L’étude du polymorphisme C677T du gène MTHFR dans la population
marocaine n'a pas montré des différences ethniques (Chi-deux = 0.933; ddl= 2;
p-value= 0,6271). La fréquence de l'allèle mutant a été similaire entre les
deux groupes ethniques majoritaires Arabes et Berbères (0,265 vs 0,261). La
distribution des génotypes dans les deux populations était en équilibre de
Hardy Weinberg (Chi-deux = 0,034, ddl = 1, p-value= 0,8537 et Chi-deux = 1,234,
ddl = 1, p-value = 0.26665). La fréquence du génotype homozygote T / T était de
6% et celle de l'allèle T de 26,3%. Ces résultats sont en accord avec une étude
antérieure qui a rapporté la fréquence du génotype T / T et de l’allèle T dans
un échantillon de la population marocaine de 8,4% et 24,5% respectivement
(Bennouar, N. et al. 2007). Cette
similitude dans la fréquence de l'allèle C677T dans les deux populations arabes
et berbères étudiées suggère une possibilité de brassage de pools géniques
entre ces deux peuples. Bien qu'il n'existe pas de preuve d'un ancêtre commun
ou de grandes vagues d'immigration entre ces populations.
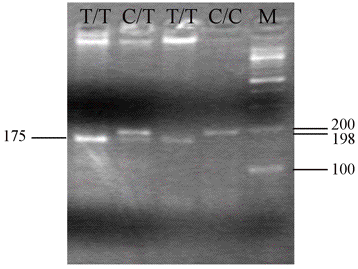
Figure 2. Profil électrophorétique de la digestion HinfI. TT: homozygote muté:
une bande de 175pb; CT: hétérozygote: une bande de 198pb et une bande de 175pb;
CC: homozygote sauvage: une bande non digéré de 198pb;
M: marqueur de poids moléculaire ladder 100; pb: paire
des bases.
Figure 2. HinfI enzymatic digestion.
Le Maroc est un pays nord-ouest africain
peuplé des populations caucasoïdes qui s'étendent de la péninsule ibérique au
Maroc à partir de 20 000 à70 000 avant J.C., vers la fin de la culture
paléolithique appelée ibéro-Marusian (Cavalli-Sforza, L.L. et al, 1994).
Les
berbères représentent la première population caucasienne ayant peuplé le Maroc.
Ils sont soupçonnés d'avoir parmi leurs ancêtres des descendants mésolithiques
capsiens et 'néolithique’, avec éventuellement la contribution génétique de
l'importante migration néolithique du Proche-Orient (Cavalli-Sforza, LL et
al, 1994).
Les
Arabes ont leur origine dans la péninsule arabique, ils ont conquis l'Afrique
du Nord (Egypte, Tunisie, Algérie et Maroc) entre les septième et onzième
siècles, lors de la grande expansion islamique. De plus, d'importantes routes
commerciales sont responsables de flux de gènes entre l'Afrique subsaharienne
et le Maroc. Tous ces facteurs ont contribué au renforcement de brassage entre
les populations existant au Maroc.
La
fréquence du génotype T / T (6%) au Maroc est intermédiaire comparée à celle
observée dans les pays européens, dont la France, l'Espagne (11,8%) et les
Noirs américains (2,7%), les populations sub-sahariennes (0%) ( Wilcken, B. et
al. 2003, Chillemi, R. et al. 2006). Dans une étude de la répartition
géographique et ethnique du polymorphisme du codon 677 du gène MTHFR, Wilcken,
B. et al. 2003, ont rapporté
que la fréquence du génotype TT est particulièrement élevée dans le nord de la
Chine (20%), le sud de l'Italie (26%) et le Mexique (32%). Le variant C677T
MTHFR est particulièrement répandue dans les populations occidentales ou
asiatiques, et beaucoup moins dans les groupes ethniques sub-sahariens
(Bauduer, F. et al, 2005). la
recherche de la mutation MTHFR C677T dans la population saura sans doute
conduire à une meilleure prévention des maladies. Une augmentation des besoins
en folates et de vitamine pourrait être indiquée pour des consommateurs dont
l’alimentation est faite d’une haute teneur en protéines, et moins fournie en
légumes et fruits.
Conclusion
Le génotype C677T
a été rencontré avec une fréquence de l’homozygote TT plus proche de l’Europe
méridionale, valeur intermédiaire entre les fréquences élevées du sud de
l’Europe et les fréquences basses
sub-sahariennes, confirmant ainsi l’hétérogénéité de la distribution de
ce polymorphisme à travers le monde et donc un modèle de la variation ethnique et populationnelle. Ce travail a le mérite
d’avoir mis à la disposition des chercheurs des données pouvant être exploiter
dans le cadre des mesures de santé
publique notamment dans la prévention des troubles vasculaires, de troubles de
fermeture du canal neural, des troubles psychiatriques, pathologies dont les
mécanismes physiopathologiques ont été associés à l’homozygotie 677 T du gène
MTHFR. L’exploration de la distribution de l’allèle et les informations
génotypiques du gène MTHFR pourront, tout en fournissant des données sur la
population de référence, contribuer aux études d’association de gène-maladies.
Remerciements. Nous remercions la population
marocaine qui a accepté de participer à cette étude. Nous sommes également
reconnaissants au personnel du centre de transfusion sanguine de Casablanca, de
nous avoir fourni des échantillons pour cette étude.
Références bibliographiques
Anvesha Srivastava, Sachchida, N., Pandey, P., Pandey, Gourdas C., Balraj M.,2008, No Association of Methylenetetrahydrofolate Reductase (MTHFR) C677T Polymorphism in Susceptibility to Gallbladder Cancer. DNA and Cell Biology. Vol 27 N° 3:127-132.
Bauduer, F., Lacombe, D., 2005, Factor V Leiden, prothrombin 20210A, Methylenetetrahydrofolate Reductase 677T, and population genetics. Mol Genet Metab, 86: 91-9.
Bennouar, N., Allami, A., Azeddoug, H., Bendris, A., Laraqui, A., El
Jaffall, A., El Kadiri, N., Benzidia, R., Benomar, A., Fellat, S., et Benomar,
M., 2007, Thermolabile Methylenetetrahydrofolate Reductase C677T Polymorphism
and Homocysteine Are Risk Factors for Coronary Artery Disease in Moroccan
Population. Journal of Biomedicine and Biotechnology, volume 2007, Article ID
80687, 9 pages.
Botto, L.D., and Yang, Q., 2000,
5,10-Methylenetetrahydrofolate reductase gene variants and congenital
anomalies: a HuGE review. Am. J. Epidemiol. 151:862-877
Cavalli-Sforza, LL., Menozzi, P., Piazza, A., 1994, the History and
Geography of Human Genes. Princeton Univ. Press.
Chillemi, R., Angius,A., Persico, I., Sassu, A., Prodi, DA., and
Musumeci, S., 2006, Methylenetetrahydrofolate Reductase (MTHFR) from
Mediterranean to Sub-Saharan Areas. J. Biol. Sci., 6 (1): 28-34.
Dilley, A., Hooper, W.C., El-Jamil, M., Renshaw, M., Wenger, N.K., and
Evatt, B.L., 2001, Mutations in the genes regulating methylene tetrahydrofolate
reductase (MTHFR C-->T677) and cystathione beta-synthase (CBS G-->A919,
CBS T-->c833) are not associated with myocardial infarction in African
Americans. Thromb. Res. 103:109-115.
Friso, S., Choi, SW., Girelli, D., Mason, JB., Dolnikowski, GG., Bagley,
PJ., Olivieri, O., Jacques, PF., Rosenberg, IH., Corrocher, R., Selhub, J.,
2002, A common mutation in the 5,10-methylenetetrahydrofolate reductase gene
affects genomic DNA methylation through an interaction with folate status.
Proc. Nat. Acad. Sci. 99: 5606-5611.
Frosst, P., Blom, HJ., Milos, R., Goyette, P., Sheppard, CA., Matthews,
RG., Boers, G JH., den Heijer, M., Kluijtmans, LA J., Van den Heuvel, LP., and
Rozen, R., 1995, A candidate genetic risk factor for vascular disease: a common
mutation in methylenetetrahydrofolate reductase. Nature Genet. 10: 111-113.
Goyette, P., Pai, A., Milos, R., Frosst, P., Tran, P., Chen, Z., Chan,
M., and Rozen, R., 1998, Gene structure of human and mouse
methylenetetrahydrofolate reductase (MTHFR). Mammalian Genome 9: 652-656.
Jacques, PF., Bostom, AG., Williams, RR., Ellison, RC., Eckfeldt, J H.,
Rosenberg, IH., Selhub, J., and Rozen, R., 1996, Relation between folate
status, a common mutation in methylenetetrahydrofolate
reductase, and plasma homocysteine concentrations. Circulation 93: 7-9.
Jerbi Z.,
Abdennebi, M., Douik, H., Ben Romdhane, H., Harzallah, L., Guemira, F., and
Ghanem, A., 2005, Étude du polymorphisme C677T du gène de la méthylène
tétrahydrofolate réductase dans la population tunisienne, Annales de Biologie
Clinique. Volume
63, Numéro 5, 487-91.
Koch, M.C., Stegmann, K., Ziegler, A., Schroter, B., and Ermert, A.
(1998) Evaluation of the MTHFR C677T allele and the MTHFR gene locus in a
German spina bifida population. Eur.J. Pediatr. 157:487-492.
Lewis, SJ., Ebrahim, S., Smith, GD., 2005, Meta-analysis of MTHFR
677C->T polymorphism and coronary heart disease: does totality of evidence
support causal role for homocystéine and preventive potential of folate?.BMJ;
331: 1053
Muntjewerff, JW., Hoogendoorn, ML., Kahn, RS., et al., 2005,
Hyperhomocysteinemia, methylenetetrahydrofolate reductase 677TT genotype, and
the risk for schizophrenia: a Dutch population based case-control study. Am J
Med Genet B Neuropsychiatr Genet 135:69–72.
Muntjewerff, J. W., Kahn, R.S., Blom, H.J., Den Heijer, M., 2006,
Homocysteine, methylenetetrahydrofolate reductase and risk of schizophrenia: a
meta-analysis. Molec. Psychiat. 11: 143-149.
Papapetrou, C., Lynch, SA., Burn, J., and Edwards, YH., 1996,
Methylenetetrahydrofolate reductase and neural tube defects. Lancet 348:58.
Sazci, A., Ergul,
E., Guzelhan, Y., et al., 2003,
Methylenetetrahydrofolate reductase gene polymorphisms in patients with
schizophrenia. Brain Res Mol Brain Res
117:104–7.
Sazci, A., Ergul, E., Kucukali, I., et al., 2005, Association of the C677T
and A1298C polymorphisms of methylenetetrahydrofolate reductase gene with
schizophrenia: association is significant in men but not in women. Prog
Neuropsychopharmacol Biol Psychiatry 29:1113–23.
Scott, JM., 2001, Genetic diversity and disease: opportunities and
challenge. Proc. Nat. Acad. Sci. 98: 14754-14756.
Selzer, RR., Rosenblatt, DS. Laxova, R., Hogan, K., 2003, Adverse effect
of nitrous oxide in a child with 5,10-methylenetetrahydrofolate reductase
deficiency. New Eng. J. Med. 349: 45-50.
Ueland, M., Steinar, H., Schneede, J., Refsum, H., and Vollset, SE.,
2001, Biological and clinical implications of the MTHFR C677T polymorphism.
Pharmacological Sciences, Vol.22, No.4.
Virgos, C.,
Martorell, L., Simo, JM., et al.,
1999, Plasma homocysteine and the
methylenetetrahydrofolate reductase C677T gene variant: lack of association
with schizophrenia. Neuroreport, 10:2035–8.
Wilcken, B., Bamforth, F., Li, Z., Zhu, H., Ritvanen, A., Redlund, M.,
et coll., 2003, Geographical and ethnic variation of the 677C>T allele of
5,10 methylenetetrahydrofolate reductase (MTHFR): findings from over 7000
newborns from 16 areas worldwide. J Med Genet, 40:619-625
Yu, L., Li, T., Robertson, Z., et al., 2004, No association between
polymorphisms of methylenetetrahydrofolate reductase gene and schizophrenia in
both Chinese and Scottish populations. Mol Psychiatry, 9:1063–5.
Zhang, G., and Dai, C., 2001, Gene polymorphisms of homocysteine
metabolism related enzymes in Chinese patients with occlusive coronary artery
or cerebral vascular diseases. Thromb. Res. 104:187