Hila, L., Ben Jemaa, L., Daoudi, R., Maazoul, F., Chaabouni, H., 2006, FISH pantélomérique: Application à
l’étude du retard mental idiopathique. Antropo, 12, 73-82. www.didac.ehu.es/antropo
FISH pantélomérique: Application à l’étude du retard mental idiopathique
Pantelomeric FISH: application to studying idiopathic mental retardation
Lamia Hila1, Lamia Ben Jemaa2, Raja Daoudi1,
Faouzi Maazoul, Habiba Chaabouni2
1Laboratoire de
Génétique Humaine Faculté de Médecine de Tunis.
2Service des maladies congénitales et héréditaires EPS Charles Nicolle, Tunis.
Correspondance: Lamia Hila. Faculté de Médecine de Tunis.
15, Rue djebel Lakhdhar- 1007 Bab Saadoun, Tunis TUNISIE. E-mail: Lamia.Hila@fmt.rnu.tn
Mots-clés: Retard mental, Réarrangements subtélomériques, Délétion, FISH
Key-words: Mental retardation, Subtelomeric rearrangements, Deletion, FISH
Résumé
La prévalence du retard mental dans la population générale est estimée à environ 3% et les anomalies chromosomiques sont observées dans environ 10 à 40% des cas constituant ainsi la première cause génétique de retard mental.
Cependant pour 60% des patients aucune étiologie n’est trouvée car il n’y a pas de phénotype caractéristique.
La cytogénétique moléculaire a permis de montrer qu’au moins 6 à 8% des retards mentaux idiopathiques pouvaient être expliqués par des anomalies cryptiques situées au niveau des régions subtélomériques
Des études récentes ont ainsi mis l’accent sur un rôle majeur (environ 10% des cas) des réarrangements chromosomiques impliquant les extrémités chromosomiques dans l’étiologie des retards mentaux idiopathiques.
Les auteurs rapportent l’application d’une nouvelle technologie pour l’étude des remaniements subtélomériques, la technique Tous Telomères ou Chromoprobe Multiprobe T System variante de l’hybridation in situ fluorescente (FISH) qui permet le screening de toutes régions subtélomériques d’un individu en une seule analyse et discutent son intérêt dans l’exploration du retard mental en Tunisie.
Abstract
The prevalence of mental retardation in the general population is about
3% and chromosomal abnormalities are observed in 10 to 40% of cases and make up
the first genetic cause of this pathology.
But for 60% of patients there is no etiology because there is no
characteristic phenotype.
With molecular cytogenetics technics (FISH) 6 to 8% of idiopathic cases
are related to subtelomeric rearrangements and many studies involves chromosomes
telomeres in about 10% of mental retardation.
The authors report an application of subtelomeric FISH in Tunisian
patients and discuss the interest of this technic in exploring mental
retardation in Tunisia.
Introduction
Le retard mental, défini comme un dysfonctionnement intellectuel associé à des limitations de la fonction adaptative, affecte environ 2 à 3% de la population générale (American Psychiatric Association , 1994; Roleveld et al, 1997).
L’étude du retard mental d’origine génétique, et en particulier la recherche et l’identification des gènes responsables de cette pathologie est un enjeu de la génétique médicale, mais constitue une tache lourde et complexe du fait de l’hétérogénéité génétique et phénotypique de la maladie.
Une estimation des gènes impliqués dans le retard mental avance les chiffres de 300 gènes dont 90 ont déjà été identifiés parmi lesquels 3 de localisation autosomique (Basel-Vanagaite et al, 2003; Castellvi-Bell et al, 2001) et plus de 70 pour le chromosome X.
Les anomalies chromosomiques représentent la cause la plus fréquente du retard mental, mais la contribution réelle des anomalies inframicroscopiques de taille inférieure à 5 mégabases reste encore inconnue.
L’association des techniques cytogénétique et moléculaire a permis d’affiner la résolution de détection des anomalies cytogénétiques et de mettre en évidence des remaniements submicroscopiques, non décelés même par des caryotypes en haute résolution. En effet, ces derniers ne peuvent déceler que des anomalies de taille supérieure à 3 Mb environ.
Des résultats récents ont mis l’accent sur le rôle majeur des réarrangements chromosomiques impliquant les extrémités chromosomiques, les télomères, dans l’étiologie du retard mental idiopathique.
Leur incidence serait estimée à 5 naissances sur 10 000 et leur fréquence à 7,4% selon Knight et al (1999). Ces chiffres sont variables selon les études et certains suggèrent une implication dans plus de 10% des cas de retard mental idiopathique.
Grâce au développement des techniques de cytogénétique moléculaire, un test ciblant toutes les extrémités chromosomiques permet d’identifier les réarrangements subtélomériques impliqués dans les formes de retard mental non étiqueté.
Le principe repose sur l’analyse simultanée de sondes spécifiques de toutes les régions subtélomériques d’un individu, marquées avec des fluorochromes différents, en une seule étape (Bocian et al, 2004).
Matériel et
méthodes
Nous nous sommes intéressés au cours de ce travail à l’analyse globale des régions subtélomériques au cours du retard mental.
L’étude a été réalisée sur 10 sujets Tunisiens des deux sexes référés au service des maladies héréditaires et congénitales de l’hôpital Charles Nicolle de Tunis, présentant un retard mental non étiqueté (ne faisant pas partie d’un syndrome connu) et sélectionnés selon les critères de la check-list de De Vries et al (2001).
Cette sélection est basée essentiellement sur l’association d’un retard mental familial à des signes dysmorphiques. Ce deuxième critère, permettrait d’augmenter la probabilité de mise en évidence d’anomalies subtélomériques.
Chaque patient de notre série a bénéficié d’une étude clinique et a été retenu suivants les critères de sélection de la check list basée sur cinq rubriques à partir desquels un score est calculé (tableau 1).
Les critères d’inclusions sont: une histoire prénatale de retard de croissance, un retard mental familial, un retard de croissance post-natal (microcéphalie, petite taille), deux signes ou plus de dysmorphie faciale (hypertélorisme, anomalies des oreilles, du nez….), des anomalies des extrémités et une cryptorchidie, avec un caryotype normal.
|
Critères |
score |
Retard mental familial-Compatible avec hérédité mendélienne -Non compatible |
1 2 |
|
Histoire prénatale de retard de croissance |
2 |
Anomalies de croissancePetite taille (1) Microcéphalie (1) Macrocéphalie (1) Grande taille (1) |
2 |
Dysmorphie faciale2 signes ou plus en particulier hypertélorisme,
anomalies du nez et des oreilles |
2 |
Autres anomaliesExtrémités (1) Anomalies cardiaques (1) Hypospade + /- Cryptorchidie (1) |
2 |
Tableau 1.
Critères de sélection (De Vries et al, 2003) (1 point pour chaque anomalie avec un score
maximum de 2).
Table 1. Check list (De Vries et al, 2003).
Tous les patients sélectionnés n’ont présenté aucune anomalie visible sur un caryotype établi à une résolution d’environ 500 bandes.
L’étude cytogénétique a été réalisée selon les méthodes classiques sur des cultures présentant un index mitotique élevé afin de permettre la détection d’anomalies chromosomiques.
Ce travail consiste à hybrider 43 sondes subtélomériques (kit Cytocell) marquées par des fluorochromes, clonées dans des cosmides, BAC et/ou PAC, d’une taille moyenne de 100 Kb et localisées à environ 300 Kb (distance entre 8 et 600 Kb maximum de l’extrémité télomérique), pour chacun des patients.
Ces sondes sont réparties sur un dispositif de 24 cases contenant chacune deux sondes subtélomériques spécifiques pour le bras court et le bras long de chaque chromosome. Les cinq télomères des chromosomes acrocentriques: 13, 14, 15, 21 et 22 ne sont pas représentés (les délétions ou duplications de ces régions, dont les extrémités sont composés d’ADN ribosomal, ne semblent pas avoir un effet phénotypiquement significatif [Knight et al, 2000a]).
L’interprétation des résultats et l’acquisition des iconographies a été réalisée à l’aide d’un microscope à épifluorescence muni de filtres spécifiques permettant la discrimination des deux signaux, rouge et vert, et des chromosomes sur une même préparation. La prise d’images a été réalisée à l’aide d’une caméra à haute résolution et d’un logiciel de capture en fluorescence, pour une bonne visualisation des signaux fluorescents.
Pour chaque case des différentes
lames, nous établissons une efficacité d’hybridation et on calcule l’efficacité
globale d’hybridation.
L’analyse des résultats n’est pas compliquée car chaque case ne contient que des sondes spécifiques d’un seul chromosome et l’interprétation des résultats est non équivoque, les deux bras de chaque chromosome étant marqués par deux fluorochromes différents spectralements indépendants rouge (Texas Red) pour le bras q et vert (FITC) pour le bras p. Ils servent de contrôle interne l’un pour l’autre (technique d’hybridation réussie). Cependant la lecture des lames nécessite un temps de microscopie très important (lecture de chaque case séparément).
Pour les chromosomes acrocentriques, uniquement 2 signaux rouges seront observés sur les bras longs pour un sujet ayant un caryotype normal en effet la panoplie de sondes utilisée ne comporte pas de sondes pour les bras courts des chromosomes acrocentriques.
Pour les autres chromosomes, deux signaux verts pour les bras courts et deux rouges pour les longs seront observés sur les extrémités respectives d’un chromosome donné pour un sujet de caryotype normal.
Les délétions des régions subtélomériques sont détectées par l’absence de signal sur une des extrémités des chromosomes analysés et les trisomies par la présence de 3 signaux de la même couleur dans une case.
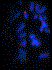
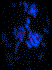
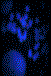
Pour chaque chromosome testé et pour chacun des cas de notre série, trois photos ont été prises pour chacune des mitoses analysées: une couleur visualisant la double hybridation des sondes subtélomériques et deux en tons de gris: images brutes de chaque signal visualisé séparément (figure 1) puis un caryotype global est reconstitué (figure 2).
 (a)
(a)
 (b)
(b)
 (c)
(c)
Figure 1. FISH
subtélomérique (FITC –Texas Red) d’un chromosome 16 (a) avec images brutes (b-c).
Figure 1. Subtelomric FISH (FITC-Texas Red) of chromosome 16
(a) and Raw pictures (b-c).
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
|
17
|
18
|
19
|
20
|
21
|
22
|
XY
|
2q
|
Figure 2. Screening global des régions
subtélomériques.
Figure 2. Global screening of subtelomeric regions.
Résultats
Nous avons procédé à l’analyse globale des régions subtélomériques par une variante de la technique FISH en deux temps:
Un pré-screening, pour chaque patient, des 24 cases (visualisation de deux couleurs de signaux) pour s’assurer de la réussite de la technique pour la totalité de la lame, suivi d’un screening minutieux de chaque case à la recherche d’anomalies cryptiques.
L’analyse des 10 sujets a montré une fluorescence positive pour tous les télomères:
Présence d’un signal rouge pour les chromosomes acrocentriques correspondants aux sondes subtélomériques de leurs bras q.
Présence de deux signaux: vert au niveau du bras court (p) et rouge au niveau du bras long (q) pour les autres chromosomes.
Nous avons retrouvé un pourcentage de 82,58% d’hybridation compatible avec les données de la littérature en effet, une hybridation est considérée efficace pour des pourcentages d’hybridation de plus de 70% (Ledbetter, 1992).
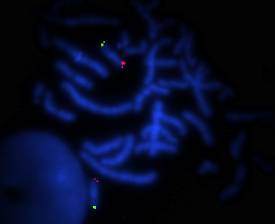
Au cours de ce travail, nous avons axé notre analyse sur certaines régions subtélomériques, en particulier le 1p, 1q et 22q car de nouveaux syndromes associant un retard mental à des délétions de ces régions ont été décrits, et notamment pour un des patients de notre série (patient 9) pour qui une suspicion d’une délétion de la région subtélomérique du bras q du chromosome 1 était suspectée d’après la clinique (anomalie du corps calleux, hypotonie sévère et dysmorphie faciale) mais n’a pas été confirmée (figure 3).
Nous avons également porté notre attention sur la région 2q car plusieurs études ont montré l’existence d’une apparente délétion de celle ci dans environ 6% des cas (avec une première génération de sondes du type cosmide) mais qui pourrait être un polymorphisme car aucune corrélation entre ces observations et le retard mental n’a pu être établie. Pour confirmer ou infirmer cette anomalie, un deuxième clone de la région 2q a été rajouté sur la case 24 du dispositif.
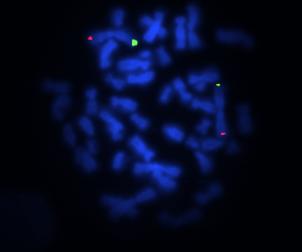
Figure 3. Hybridation subtélomérique du chromosome 1 du
patient 9.
Figure 3. Subtelomeric hybridation of chromosome 1
of patient 9.
Discussion
L’étiologie du retard mental reste
encore inconnue dans environ 50% des cas (Bocian et al, 2004). Des anomalies
congénitales, des signes dysmorphiques ou un retard mental sévère peuvent faire
suspecter une anomalie chromosomique.
De même des anomalies chromosomiques ont été décrites chez des enfants avec un retard mental sans signes dysmorphiques ni autres anomalies associées (Curry et al, 1996).
Pour ces raisons, l’établissement d’un caryotype fait parti de l’évaluation de chaque enfant avec retard mental (Curry et al, 1997; Des Portes et al, 2002).
En effet, les
réarrangements chromosomiques, de nombre ou de structure, peuvent entraîner des
aneuploïdies de chromosomes entiers ou de segments chromosomiques et altérer le dosage génique
des gènes et notamment des gènes de développement (Bocian et al, 2004).
Les anomalies de structure, dues à des cassures chromosomiques ou des recombinaisons illégitimes de régions variables du génome (De Vries et al, 2003), résultent en grande majorité de remaniements parentaux équilibrés, transmis à leur descendance sous forme déséquilibrée. Ces anomalies entraînent soit des interruptions de gènes soit une dérégulation de leur expression ou encore des monosomies et trisomies partielles.
Les microdélétions consistent en la perte d’un petit fragment chromosomique, au cours du processus de réappariement des chromosomes, et sont responsables de l’apparition de signes cliniques malgré l’aspect apparemment équilibré du caryotype standard.
Certaines régions chromosomiques riches en séquences
répétées sont des localisations préférentielles de survenue de ce type
d’anomalie par un mécanisme de recombinaison inégale entre les deux chromosomes
homologues.
Les télomères ou régions terminales des chromosomes sont concernés par ce processus. Formés de répétitions en tandem d’un héxamère TTAGGG de 3 à 20 kilobases de longueur (Allshire et al, 1989; Moyzis et al, 1988; Zakian, 1995), autour desquels s’enroulent des complexes protéiques à rôle stabilisateur et protecteur contre la dégradation des extrémités chromosomiques, ils sont essentiels à la réplication (Marcand et al, 1997).
Au voisinage de ces séquences répétées se trouvent des régions subtélomériques subdivisées en deux subdomaines proximal et distal:
Des séquences uniques spécifiques de chaque extrémité chromosomique localisées à 100-300 kilobases de l’extrémité du chromosome et des séquences répétées, de type mini satellites, polymorphes communes à plusieurs chromosomes (Brown et al, 1990; Knight et al, 2000a; Youngman, 1992).
La richesse en gènes de ces régions et la fréquence élevée de recombinaisons génétiques en particulier chez les garçons laissent à supposer que des micro-délétions ou duplications dans ces régions seraient en rapport avec un phénotype anormal.
Ces micro- microremaniements, non décelables en cytogénétique classique, seraient à l’origine d’avortements spontanés répétés et de retards mentaux le plus souvent associés à des malformations ou à des signes dysmorphiques (De Vries et al, 2001; Knight et al, 1999).
Ainsi en plus de leur implication dans le processus du cancer, les télomères semblent avoir une influence sur le développement du cerveau: les grandes délétions télomériques s’accompagnent presque toujours d’un retard mental sévère traduisant l’implication de gènes intervenant dans le développement du cerveau (Flint et al, 1996; Nossagne et al, 2001).
Au vu de ces résultats, plusieurs équipes ont entrepris
l’étude systématique des anomalies télomériques et en particulier
subtélomériques chez des enfants atteints de retard mental idiopathique et de
syndromes dysmorphiques non étiquetés (Knight et al, 2000a, b) afin d’estimer leur fréquence et leur réelle
implication dans les retards mentaux sans étiologie précise.
La technique utilisée au cours de ce travail chromoprobe multiprobe system, introduite pour la première fois dans notre laboratoire, est une variante de l’hybridation in situ fluorescente (FISH) qui a l’avantage de permettre le screening de toutes les régions subtélomériques d’un individu en une seule réaction d’hybridation.
Cette analyse
globale de tous les télomères, constitue une technique de choix pour visualiser les remaniements
cryptiques subtélomériques qui sont de très petite taille: de l’ordre du
mégabase
La non détection de remaniements subtélomériques, pour les patients de notre série, peut être expliquée par le faible nombre de patients recrutés, en rapport avec le prix, très onéreux, du kit et la difficulté du choix des critères d’inclusion.
En effet, nous avons essayé de sélectionner nos patients sur un maximum des critères rapportés par De Vries et al (2001) et Walter et al (2004), cependant ces derniers sont peu satisfaisants, car la check-list en elle-même rapporte qu’aucune des fréquences de ces signes cliniques étudiés sur une population de patients présentant des anomalies télomériques (déjà identifiées) ne semble avoir de différence significative avec les fréquences observées pour des sujets contrôles (enfants avec retard mental d’étiologie inconnue avec caryotype normal) (De Vries et al 2001).
Cette observation pourrait être en rapport avec un biais de sélection qui s’explique par le coût élevé du test qui ne permet pas un screening sans sélection.
Cette présélection clinique est importante voire obligatoire, en effet une étude tout venant des retards mentaux pour la recherche de remaniements subtélomériques ne semble pas concevable vu le temps de mise en œuvre technique (hybridation et interprétation microscopique) et le prix des dispositifs multiprobes.
En dépit de l’utilisation d’une population de témoins sélectionnée, les résultats mettent l’accent sur l’existence de deux critères majeurs en faveur de remaniements subtélomériques: le retard mental familial modéré ou sévère et l’histoire prénatale de retard de croissance (odd ratio égal à 3,7 et 6,3) (De Vries et al, 2001).
Dans notre série uniquement deux patients ont présenté une histoire prénatale de retard de croissance et six un retard mental familial mais De Vries et al rapportent que la présélection des patients ne doit pas être basée uniquement sur les deux critères majeurs mais conjointement avec les autres signes cliniques.
Le choix de recruter des patients avec un maximum de critères avait pour but d’avoir le maximum de probabilité de détection d’anomalies subtélomériques, pour rentabiliser le kit qui reste extrêmement cher à utiliser pour un dépistage systématique sur de grandes séries, et avoir une idée sur la fréquence des anomalies subtélomériques chez des patients Tunisiens.
L’absence de détection d’anomalies subtélomériques au cours de ce travail, n’est pas contradictoire avec les travaux de la littérature, en effet une revue des différentes études (20 études) sur des séries beaucoup plus importantes, trouve des pourcentages de détection d’anomalies subtélomériques variant de 0 à 36% avec une prévalence globale de 5,1% (Basel-Vanagaite et al, 2003; Castellvi-Bell et al, 2001; Walter et al, 2004).
Cette variabilité (tableau 2) met l’accent sur la difficulté de l’estimation réelle de ces anomalies dans le retard mental.
En effet, plusieurs équipes rapportent un très faible taux d’anomalies (Lamb 2,3% et Sismani 1,4%) voire aucune anomalie même sur de grandes séries de patients (Karneebek 0,5% et Joyce 0%).
|
Technique |
Individus |
Individus avec |
Auteurs |
|
|
Testés |
anomalies télomériques |
|
|
Hypervariable DNA polymorphism |
99 |
3 (6 %) |
Flint et al |
|
Multiprobe FISH |
17 |
4 (32,0 %) |
Viot et al |
|
Multiprobe FISH |
209 |
8 (3,8 %) |
Vorsanova et al |
|
Multiprobe FISH |
466 |
22 (4,7 %) |
Knight et al |
|
Multiprobe FISH |
43 |
1 (2,3 %) |
Lamb et al |
|
Multiprobe FISH |
27 |
2 (7,4 %) |
Slavotinek et al |
|
FISH probe |
154 |
4 (2,6 %) |
Ballif et al |
|
Multiprobe FISH |
200 |
13 (6,5 %) |
Rossi et al |
|
Multiprobe FISH |
254 |
13 (5 %) |
Riegel et al |
|
Multiprobe FISH+microsatellite |
30 |
2 (6,6 %) |
Borgione et al |
|
Multiprobe FISH |
200 |
0 (0 %) |
Joyce et al |
|
Microsatellite markers |
150 |
16 (10,7%) |
Rio et al |
|
Microsatellite markers |
120 |
5 (4 %) |
Rosenberg et al |
|
Multiprobe FISH+MAPH |
70 |
1 (1,4%) |
Sismani et al |
|
CGH + Multiprobe FISH |
14 |
5(35,7%) |
Joly et al |
|
Multiprobe FISH |
50 |
2 (4%) |
Clarkson et al |
|
Multiprobe FISH |
111 |
10 (9 %) |
Anderlid et al |
|
Multiprobe FISH |
250 |
9(4 %) |
Baker et al |
|
Multiprobe FISH |
184 |
1(0,5%) |
Karnebeek et al |
|
Multiprobe FISH |
33 |
3(9,1%) |
Helias-Rodzewicz et al |
Total |
2570 |
124 (4,8 %) |
|
Tableau 2. Etudes des subtélomères chez des patients
avec retard mental idiopathique (De Vries et al, 2003).
Table 2. Studies of subtelomeres in patients with
idiopathic mental retardation (De
Vries et al, 2003).
La différence de fréquence des anomalies subtélomériques rapportée dans la littérature peut être expliquée par la différence des critères de sélection adoptés mais également par la technique utilisée dans chaque étude ainsi que le nombre des patients pour chaque série étudiée.
La diversité des résultats des études des remaniements subtélomériques met l’accent sur la difficulté de la mise en place d’une check-list de spécificité et sensibilité élevée pour la présélection des patient à tester en effet, plus on élève le score plus grande est la spécificité (on limite le nombre de patients à analyser) mais moindre est la sensibilité (on peut passer à coté de certains cas).
Les
anomalies chromosomiques constituent l’étiologie la plus fréquente du retard
mental et le rôle des réarrangements subtélomériques semble de plus en
plus évident dans la pathologie du
retard mental par conséquent, il est
nécessaire de faire de plus larges études en établissant des critères de
sélection plus strictes pour établir la prévalence réelle du retard mental du
aux remaniements subtélomériques.
Ainsi la poursuite de ce
travail, sur une grande série est envisagée pour estimer la contribution réelle des anomalies
subtélomériques chez les patients tunisiens.
Cependant, les techniques de FISH pantélomériques, certes performantes, restent onéreuses et fastidieuses et seuls les patients sélectionnés selon des critères cliniques sont actuellement testés tout en sachant que ces critères de présélection ne sont pas entièrement satisfaisants.
Par conséquent, cette technique est peu adaptée à un dépistage systématique des enfants atteints de retard mental d’où il serait plus intéressant de procéder à un screening global des régions subtélomériques à la recherche de délétions et/ou duplications par une nouvelle technique, variante de la PCR: Multiplex Ligation Probe Amplification ou MLPA (Van Karnebeek et al, 2002) qui est une méthode fiable rapide et peu coûteuse.
Cette accessibilité permet un screening étendu à une large population de patients présentant un retard mental (ou un autisme) ce qui devrait aboutir à une meilleure caractérisation des caractères phénotypiques associés à ces réarrangements qui à l’heure actuelle sont probablement sous diagnostiqués.
Dans un deuxième temps, une confirmation par la technique de FISH télomère ciblé sera réalisée pour les anomalies décelées.
Par conséquent une
l’approche la plus pertinente de l’étude des remaniements subtélomériques, dont
l’implication dans le retard mental
n’est plus a démontré, serait de
faire un pré-screening par les premières techniques (PCR) et l’utilisation du Multiprobe serait
alors un test de deuxième intention.
Conclusion
La découverte d’anomalies subtélomériques identifiés chez des enfants présentant un retard mental non expliqué et le recueil précis des éléments phénotypiques conduiront ainsi à caractériser de nouveaux syndromes délétionnels ce qui facilitera l’orientation de l’examen vers un ou quelques télomères.
En effet, une meilleure connaissance des étiologies du retard mental permettra de mieux préciser le pronostic, la prise en charge des patients mais également le conseil génétique.
De même ces anomalies constituent un élément de choix pour l’identification de nouveaux gènes essentiels au développement cérébral et à la mise en place des fonctions cognitives.
Références
Allshire, R.C., Dempster, M., Hastie, N.D.,1989, Human telomeres contain at least three types of G-rich repeat distribution non-randomly. Nucleic Acids Res, 17, 4611-27.
American
Psychiatric Association. DSM-IV, 1994, Diagnostic and statistical manual of
mental disorders.4th
ed.Washington DC: The American Psychiatric Association.
Basel-Vanagaite, L., Alkelai, A., Shohat, M., 2003, Mapping of a new locus for autosomal recessive non-syndromic mental retardation in the chromosomal region 19p13.12-p13.2: further genetic heterogeneity. J Med Genet, 40,729-32.
Bocian, E., Hélias-Rodzewicz Z., 2004 Subtelomeric rearrangements: Results from FISH Studies in 84 families with idiopathic mental retardation. Med Sci Monit, 10(4),CR143-151.
Brown, W.R., Mackinnon, P.J., Villasante, A., Spurr, N., Buckle, V.J., et Dobson, M.J., 1990, Structure and polymorphism of human telomere-associated DNA. Cell, 63, 119-132.
Castellvi-Bell, S., Mila, M., 2001, Genes responsible for mental retardation. Mol Genet Metab, 72, 104-8.
Curry, C.J., Sandhu, A., Frutos, L.,Wells, R., 1996, Diagnostic yield of genetic evaluations in Developmental delay/mental retardation. Clin Res, 44, 130 A.
Curry, C.J.C., Stevenson, R.E., Aughton, D., 1997, Evaluation of mental retardation: Recommendations of a consensus conference. Am J Med Genet, 72, 468-477.
Des Portes, V., Livet, M. O., Vallée, L., et le groupe de travail de la société française de neuropédiatrie (SFNP) sur les retards mentaux, 2002, Démarche diagnostique devant une déficience mentale de l’enfant en 2002. Arch Pediatr, 7, 709-25.
De Vries, B.B.A., White, S.M., Knight, S.J.L., 2001, Clinical studies on submicroscopic Subtelomeric rearrangements: a checklist. J Med Genet, 38, 145-150.
De Vries, B.B.A., Winter, R., Schinzel, A., Van Ravenswaaij-Arts, C.,2003, Telomeres: A diagnosis at the end of the chromosomes. J Med Genet, 40, 385-398.
Flint, J., Knight, S., 2003, The use of telomere probes to investigate submicroscopic rearrangements associated with mental retardation. Current Opinion in Genetics and Development, 13, 310-316.
Flint, J., Thomas, K., Micklem, G., 1997, The relationship between chromosome structure and Function at a human telomeric region. Nat Genet, 15, 252-7.
Flint, J., Wilkie, A.O.M., 1996, The genetic of mental retardation. British Medical Bulletin 52(3), 453-464.
Hélias-Rodzewicz, Z., Bocian, E., Stankiewicz, P., 2002, Subtelomeric rearrangements detected by FISH in three of 33 families with idiopathic mental retardation and minor physical anomalies. J Med Genet, 39, e53.
Joyce, C.A., Dennis, N.R., Cooper, S., Browne, C.E., 2001, Subtelomeric rearrangements: results from a study of selected and unselected probands with idiopathic mental retardation and control individuals by using High-resolution G-banding and FISH. Hum Genet; 109:440-451.
Knight, S.J.L., Flint, J., 2000a, Perfect endings: a review of subtelomeric probes and their use in clinical diagnosis. J Med Genet, 37:401-409.
Knight, S.J.L., Lese, C.M., Precht, K.S., 2000b, An optimised set of human telomere clones for studying telomere integrity and architecture. Am J Hum Genet, 67, 320-332.
Knight, S.J.L., Regan, R., Nicod, A., 1999, Subtle chromosomal rearrangements in children with unexplained mental retardation. Lancet, 354, 1676-81.
Lamont, M.A., Dennis, N.R.,1988, Aetiology of mild mental retardation. Arch Dis Child, 63, 1032-8.
Ledbetter, D.H., 1992, Minireview: cryptic translocations and telomere integrity. Am J Hum Genet, 51, 451-456.
Marcand, S., Brun, C., Ancelin, K., Gilson, E., 1997, Les télomères: du normal au pathologique. Médecine/ Sciences, 13, 1250-8.
Mclaren, J., Bryson, S.E., 1987, Review of recent epidemiological studies of mental retardation: Prevalence, associated disorders, and etiology. Am J Ment Retard, 92, 243-254.
Moyzis, R.K., Buckingham, J.M., Cram, L.S, 1988, A highly conserved repetitive DNA sequence, (TTAGGG) n, present at the telomeres of human chromosomes. Proc Natl Acad Sci USA, 85, 6622-6.
Nossagne, M.C., De Lonlay-Debeney, P., Touati, G., Saudubray, J.M., 2001, Retards mentaux: métabolismes, investigations biologiques. Pédiatrie, 4, 90-97.
Raynham, H., Gibbons, R., Flint, J., Higgs, D., 1996, The genetic basis for mental retardation.Q J Med, 89, 169-175.
Roleveld, N., Zielhuis, G.A., Gabreels, A., 1997, The prevalence of mental retardation: A critical review of Recent literature. Dev Med Child Neurol, 39, 125-32
Rooms,l., Reyniers, E., Van Luijk, R., Scheers, S., Wauters, J., Ceuler, B., Van Den Ende, J., Van Bever, Y et Kooy, R.F., 2004, Subtelomeric deletions detected in patients with idiopathic mental retardation using Multiplex Ligation –Dependent Probe Amplification (MLPA). Human Mutation, 23, 17-21.
Schaefer, G.B., Bodensteiner, J.B. 1992, Evaluation of the child with idiopathic mental retardation. Paediatr Clin North Am, 39, 929-943.
Van Karnebeek, C.D.M., Koevoets, C., Sluijter, S., 2002, Prospective screening for subtelomeric rearrangements in Children with mental retardation of unknown aetiology: The Amsterdam experience. J Med Genet, 39, 546-553.
Walter,
S., Sandig, K., Hinkel, G.K., 2004, Subtelomere FISH in 50 Children with mental
retardation and minor anomalies, Identified by a Check list, Detects 10 rearrangements
including a de
novo balanced translocation of
chromosomes 17p13.3 and 20q13.33. American Journal of Medical Genetics, 128A,
364-373.
Youngman,1992, The telomeric 60 kb of chromosome 4p is homologous to telomeric regions on 13p, 15p, 21p and 22p. Genomics, 14, 350-356.
Zakian, V.A., 1995, Telomeres: begining to understand the end. Science, 270(5242), 1601-7.