
Mehri, S., Boussaada, R., Mahjoub, S., Guemira, F., Vuillaumier-Barrot, S., Mechmeche, R., Durand, G., Ben Arab, S., 2005, Le polymorphisme du gène de l'enzyme de conversion de l'angiotensine et le risque de l'infarctus du myocarde en Tunisie. Antropo, 10, 75-81. www.didac.ehu.es/antropo
Le
polymorphisme du gène de l'enzyme de conversion de l'angiotensine et le risque
de l'infarctus du myocarde en
Tunisie
Angiotensin-converting
enzyme gene polymorphism and risk of myocardial infarction in Tunisia
S. Mehri1, R. Boussaada1,4, S.
Mahjoub1, F. Guemira2, S. Vuillaumier-Barrot3,
R. Mechmeche4, G. Durand3, S. Ben Arab1
1 Unité
d`Epidémiologie Génétique et Moléculaire à la Faculté de Médecine de Tunis.
Tunisie (benarab_saïda@yahoo.fr)
2 Laboratoire de
Biochimie et Biologie Moléculaire à l’Hôpital Salah Azaiez de Tunis.
3 Laboratoire de
Biochimie A à l’Hôpital Bichat-Claude Bernard- Paris.
4
Services
des explorations fonctionnelles Cardiologiques. Hôpital La Rabta Tunis. Tunisie
Mots-clés: Infarctus du myocarde, Enzyme
de conversion de l'angiotensine, Polymorphisme, variant D, Variant I.
Keywords: Myocardial
infarction, Angiotensin-converting enzyme, Polymorphism, Variant D, Variant I.
Resumé
L’expression du gène de l’enzyme de conversion d’angiotensine II semble être corrélée au risque d'infarctus du myocarde. Dans ce cadre, nous avons analysé le polymorphisme génétique insertion/délétion (I/D) de l’enzyme de conversion d’angiotensine II à travers une étude cas-témoins. Trente six patients atteints d`infarctus du myocarde (groupe 1) d’âge moyen 57,13 ± 10,57 ans (35-81) ont été comparés à 37 témoins (groupe2) d'âge moyen de 54 ± 18,38 ans (25-81). Après l'extraction de l'ADN leucocytaire, la séquence d'intérêt avait été amplifiée par Polymerase Chain Reaction et analysée par électrophorèse. Les résultats obtenus ont montré un génotype DD dans 52,78 % dans le groupe 1 versus 27,03 % dans le groupe 2 (p <0,05). La fréquence de l'allèle D était de 70,84% dans le groupe 1 versus 56,75% dans le groupe 2 (p <0,05). L'odds-ratio de l'allèle D étant estimé à 1,85 (p <0,05). Par ailleurs, il a été démontré que l'expressivité du gène de l’enzyme de conversion de l’angiotensine est corrélée à l'activité enzymatique de cette dernière, et par conséquent à celle de l'angiotensine II. Celle-ci étant identifiée comme un facteur de risque indépendant d'athérosclérose artérielle. Des études ultérieures de la relation entre le polymorphisme du gène de l’enzyme de conversion de l’angiotensine et la concentration plasmatique de cette dernière seront nécessaires afin de mieux comprendre le rôle de génotype DD dans l'IDM.
Abstract
The expression of the
Angiotensin-converting enzyme gene seems to be associated with myocardial
infarction risk (MI). Therefore, we have analyzed an insertion/deletion (ID)
polymorphism in the angiotensin-converting enzyme gene through a case-control
study. Thirty six patients affected with history of MI
(group 1) mean age 57.13 ± 10.57 years (35-81), have been compared to 37
controls (group 2) mean age 54 ± 18.38 years (25-81). After the extraction of
leucocytes DNA, the sequence of interest have been amplified by Polymerase
Chain Reaction and analyzed by electrophoresis. Obtained results showed a DD
genotype frequency 52.78 % in group 1 versus 27.03 % in group 2 (p
<0.05). Allele D frequency was
70.84% in group 1 versus 56.75% the group 2 (p <0.05). Allele D odds-ratio
was estimated to 1.85 (p <0.05). On other hand, it has been shown that ACE
gene expressivity was correlated with ACE activity. Further studies of relation
between of ACE gene polymorphism and enzyme plasmatic concentration are
warranted, for better understanding of DD genotype role in MI.
Introduction
Au cours des dernières décennies, plusieurs études ont été
entreprises afin d'analyser les
facteurs de risque de l’athérosclérose coronaire principale cause de
l'infarctus du myocarde (IDM) (Vigen, 2005; Libby, 2002; Ganz, 1996). Parmi ces
facteurs, la composante génétique demeure controversée. Ainsi depuis quelques
années un intérêt particulier avait été accordé au polymorphisme du gène de
l'enzyme de conversion de l'angiotensine (ECA) (Sourbier, 1988) qui semble être
un excellent marqueur de risque de l'IDM. Le gène de l’ECA humain est localisé
sur le chromosome 17 en position 17q23 (Cambien et sourbier, 1995). Le
polymorphisme dans ce gène comprend deux variants: I (Insertion) et D
(Délétion) d’un fragment de 287 pb présent dans l’intron 16 de ce gène (Rigat
et al., 1990).
En 1992, Cambien et al (1992) avaient identifié le génotype DD du gène de l'ECA comme étant prédisposant à l'IDM. De plus, certains auteurs ont montré l'existence d'une relation entre le génotype DD et un IDM précoce chez les individus de sexe masculin (Cambien et al., 1994; Petrovic et al., 2004). Des études d'associations ayant été entreprises dans différentes ethnies avaient montré une prédominance du génotype DD chez les patients atteints d'IDM (Bautista et al., 2004; Matabalaguer et al, 2004). Ainsi que, une fréquence élevée de l'allèle D entraînant une augmentation du risque de développer un IDM (Hooper et al., 2002; Fukazawa et al., 2004; Karaali et al., 2004).
Par ailleurs, il a été démontré que l'expression du gène de
l'ECA serait corrélée à l'activité de l'ECA, et par conséquent à la
concentration plasmatique de l'angiotensine II. Ainsi, le génotype DD est
associé à une augmentation de la
concentration plasmatique d'ECA.
L'objectif de
ce travail consiste à chercher une éventuelle association entre le
polymorphisme I/D du gène de l'ECA et l'IDM et d'évaluer la valeur morbide du
génotype DD chez des patients ayant présenté un IDM, à travers une étude d'association
cas-témoins.
Matériel
et Méthodes
Population d’étude
La population d’étude considérée a été répartie en deux groupes : le groupe 1 fait de 36 patients atteints d’IDM et le groupe 2 (témoin) comportant 37 individus sains. Les patients ont été recrutés dans les services des explorations fonctionnelles cardiologiques de l’Hôpital-La Rabta à Tunis. Le critère principal d’inclusion à l’étude dans le groupe 1 était l’antécédent d’IDM. L’âge moyen dans ce groupe est de 57,13 ± 10,57 ans (35 à 81 ans) versus 54 ± 18,38 ans (25 à 81 ans) dans le groupe 2. Dans le groupe 1, 30/36 patients sont de sexe masculin versus 27/37 dans le groupe 2.
Génotypage
L’extraction de l’ADN génomique a été effectuée à partir du sang périphérique par la méthode phénol/chloroforme. L’ADN génomique a été amplifié par Polymerase Chain Reaction (PCR). L'identification des génotypes a été faite par migration électrophorétique sur gel d’agarose à 2,25 %, contenant 1µl de bromure d’éthidium. La confirmation du génotype DD a été réalisée par amplification avec des amorces encadrant l’insertion. L'estimation des fréquences génotypiques (II, ID et DD) et des fréquences alléliques (I et D) a été faite en supposant l’équilibre de Hardy-Weinberg.
Méthodologie statistique
Les fréquences génotypiques et alléliques ont été comparées dans les groupes 1 et 2 en utilisant le test Khi-deux. Le risque relatif associé à l’allèle D était estimé par l’Odds-Ratio au seuil de signification de 5%.
Résultats
Les bandes de l’électrophorèse ont permis d’identifier trois génotypes : les bandes 490 pb, 190 pb correspondent respectivement aux homozygotes de génotype II et DD. Les deux bandes 190 pb et 490 pb ont été identifiées dans le cas de l’hétérozygote de génotype ID (figures 1 et 2).
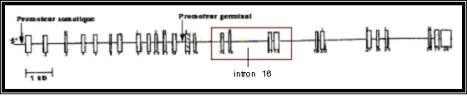
Figure 1. Organisation du gène de l’enzyme
de conversion de l’angiotensine Humaine (Cambien et Sourbier, 1995).
Figure 1.
Organization of the human ACE gene
(Cambien et Sourbier, 1995).
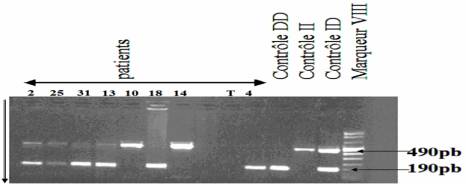
Figure 2. Profil de migration éléctrophorétique des produits de PCR et
différents génotypes des malades par Photoshop. Les numéros : 2, 25, 31,
13, 10,18, 14, 4 correspondent aux patients atteints d’IDM; T: témoin; les
bandes 490 pb et 190 pb
correspondent respectivement à la présence de l’insertion (I) et de la
délétion (D).
Figure
2. Profile of electrophoresis migration of PCR products
and different genotypes of patients by Photoshop. The numbers: 2, 25, 31, 13,
10, 18, 14, 4 corresponding to patients with MI; T: control; the bands 490
pb and 190 pb are corresponding to
presence of insertion (I) and deletion (D) respectively.
Cette
électrophorèse avait été complétée par une PCR de confirmation
dans le cas des individus ayant le génotype DD, par l'absence d’amplification
du fragment d’ADN en question
(figure 3).

Figure 3. profil de migration
éléctrophorétique des produits de PCR de confirmation des individus de génotype
DD par Photoshop. Les numéros 4,
8, 35, 24, 19, 7, 33, 6, 29, 12, 30, 23, 32, 2 correspondent aux patients
atteints d’IDM.
Figure3. Profile of electrophoresis migration of PCR confirmation products of
patients with DD genotype by Photoshop. The numbers 4, 8, 35, 24, 19, 7, 33, 6,
29, 12, 30, 23, 32, 2 are corresponding to patients with MI
L’analyse
des résultats avait montré une prédominance du génotype DD dans le groupe 1
(52,78 %) versus (27,03%) dans le groupe 2 (P<0,05).
A l’opposé, le génotype ID était
plus fréquent dans
le groupe 2 (59,46%) versus (36,11%) dans le
groupe 1 (P<0,05). La fréquence du génotype II
était similaire dans les deux groupes. les résultats des fréquences
génotypiques sont résumés dans le tableau 1.
|
Génotypes |
Groupe 1 (n= 36) |
Groupe 2 (n= 37) |
probabilité |
|
DD (%) |
52,78 |
27,03 |
< 0,05 |
|
ID (%) |
36,11 |
59,46 |
< 0,05 |
|
II (%) |
11,11 |
13,51 |
>0,05 |
Tableau 1.
Répartition des fréquences génotypiques dans les groupes 1 et 2.
Table1. Distribution of
genotypes frequencies in the two groups.
Au
même titre que le génotype DD, l’allèle D prédominait
seulement dans le groupe 1; la fréquence de l’allèle D était de 70,84% versus 29,2% de l’allèle I (P<0,05). Dans le groupe 2,
les fréquences des allèles D et I étaient statistiquement équivalentes (tableau
2).
|
|
D |
I |
Total |
Probabilité |
||
|
nombre |
% |
nombre |
% |
|||
|
Groupe 1 |
51 |
70,84 |
21 |
29,2 |
72 |
< 0,05 |
|
Groupe 2 |
42 |
56,75 |
32 |
43,25 |
74 |
> 0,05 |
Tableau 2.
Répartition des fréquences alléliques dans les groupes 1 et 2.
Table 2.
Distribution of allelic frequencies in the two groups.
Par ailleurs, le risque de
contracter un IDM en rapport avec la présence de l’allèle D était estimé
par un Odds-Ratio (OR = 1,85;
P<0,05).
Discussion
Depuis
quelques années, des recherches ont été entreprises sur le polymorphisme dans
le gène de l’ECA, qui semble être un excellent marqueur de risque d’IDM. Ce
polymorphisme I/D est le fait de la présence ou de l'absence d'un fragment de
287 pb au niveau de l'intron 16 de ce gène.
La relation entre le génotype DD et l'IDM a fait l'objet de
quelques études Européennes et sud Américanes (Tableau 3).
|
|
Année |
Origine ethnique |
N |
N1 |
N2 |
Pourcentage génotype
DD |
Probabilité |
|
|
Groupe 1 |
Groupe 2 |
|||||||
|
Cambien et al. |
1992 |
France |
1343 |
610 |
733 |
35 |
8 |
<0,01 |
|
Bautista et al. |
2004 |
Colombie |
202 |
101 |
101 |
39,6 |
26,7 |
<0,05 |
|
Mendonca et al. |
2004 |
Portugal |
811 |
301 |
510 |
41,2 |
28,1 |
<0,0001 |
|
Mata-Blaguer et al. |
2004 |
Espagnole |
210 |
104 |
106 |
66,34 |
25,47 |
<50.10-8 |
|
Série personnelle |
2005 |
Tunisie |
73 |
36 |
37 |
52,78 |
27,03 |
< 0,05 |
Tableau 3. Distribution de
génotype DD des malades et des
témoins selon différentes études. N : Effectif total ; N1 :
Effectif des patients ;
N2 : Effectif des témoins.
Table
3. Distribution of DD genotypes of patients and
controls according differents studies. N:
Global number; N1: Number of patients; N2: Number of
controls
L'analyse de la littérature a montré une nette prédominance
du génotype DD chez le groupe atteint d'IDM par rapport au groupe témoin. Il a
été précisé dans l'étude de Cambien et al (1992) que les patients atteints
d'IDM sont de génotype DD. Parallèlement aux données de la littérature, nos
résultats ont montré que le génotype DD est plus fréquent dans le groupe 1 que
dans le groupe 2 (p<0,05). Ainsi le génotype DD apparaît comme un facteur
prédisposant à l'IDM dans la population tunisienne. L'ECA pourrait-elle être
considérée comme un facteur de risque dans la population Tunisienne. Le
génotype ID était plus fréquent dans le groupe 2 que dans le groupe 1
(p<0,05). Il aurait un effet cardioprotecteur contre l'IDM. Cependant,
d'autres études n'ont pas retenu le caractère prédisposant du génotype DD à
l'IDM (Ranjith et al., 2004 ;
Sobstyl et al., 2002 ; Samani et al., 1996 ; Winkelmann et al., 1996;
Freidl et al., 1995; Katsuya et al., 1995 ).
Par ailleurs,
des études menées sur des individus atteints d’IDM dans différentes ethnies ont
montré une prédominance de la fréquence de l’allèle D chez les malades. Cette
prédominance est de 61% chez les américains d’origine africaine (Hooper et al.,
2002), 65,54% chez les Turques (karaali et al., 2004). Par contre, elle est
relativement plus basse de 32 à 39% chez les japonais (Ishigami et al., 1995).
Cependant, il y’a peu d’informations en ce qui concerne les populations arabes
et nord-africaines. Les résultats obtenus dans l'échantillon Tunisien ont
montré que l’allèle D est plus fréquent que l’allèle I dans le groupe 1
(p<0,05). Dans le groupe 2, aucune différence significative n’a été
trouvée entre l’allèle D et I. Par
ailleurs, l'estimation de l'odds-ratio étant égale à 1.85, l'allèle D est
considéré comme un facteur prédisposant à l’infarctus du myocarde. Ce résultat
nous permet de déduire que le gène de l'ECA est un gène de susceptibilité à
l'infarctus du myocarde dans la population Tunisienne. Par contre, d’autres
études ont infirmé l'association entre l’allèle D et l’IDM (Fillipi-Codaccioni
et al., 2004; Holmer et al., 2003).
En ce qui
concerne la fréquence de l’allèle D chez les individus sains, Cambien et al (1992) ont trouvé que dans la
population française la fréquence de l’allèle D est égale à 57%. Ce résultat
est semblable à celui trouvé dans l’échantillon témoin Tunisien (56,7%). De
même, la fréquence du génotype DD chez les témoins Tunisiens (27,03%) est
identique à celle des témoins français (30%). Cependant, cette constatation
doit être retenu sous la réserve de l'homogénéité des populations considérées.
Par ailleurs, dans le groupe 1, sur 19 patients atteints
d'IDM et de génotype DD, 18 sont de sexe masculin ce qui présente 94,75 %.
Ainsi, il semble que l'association de sexe masculin-génotype DD apparaît comme
prédisposant à l'IDM. Bien évidemment, ces constatations ouvrent la voie à
d'autres recherches concernant la relation entre le génotype DD et les facteurs
de risque d'athérosclérose artérielle de manière générale.
Par
ailleurs, l’enzyme de conversion existe sous deux formes tissulaire et
plamatique dont la concentration est stable chez un même individu mais présente
une grande variabilité
inter-individuelle pouvant être expliquée par l’origine génétique liée à ce
polymorphisme (Cambien, 1994). La relation entre le polymorphisme du gène de
l’ECA et la concentration plasmatique de l’ECA est bien établie (Rigat et al.,
1990). Ainsi, le génotype DD est associé à une forte concentration d’ECA
circulante. Alors que dans le cas des génotypes II et ID, la concentration
d’ECA circulante, est respectivement faible et intermédiaire. Ainsi, le
génotype DD est associé aux activités plasmatiques de l'ECA les plus élevées et
par conséquent aux plus fortes concentrations plasmatiques d'angiotensine II
(Cambien et al., 1992). Nos données et celles de la littérature nous permettent
de suspecter une relation entre l'expression du gène de l'ECA et l'IDM. Le mécanisme par lequel le
polymorphisme (ECA/ID) peut affecter la morbidité et la mortalité des malades
cardiovasculaires n’est pas encore élucidé (Sayad-tabatabaei et al.,
2005). Le lien éventuel entre le
polymorphisme du gène de l'ECA et l'IDM, pourrait s'expliquer par la
concentration plasmatique élevée de l'angiotensine II.
Conclusion
Les
résultats obtenus sur les cas-témoins nous permettent de conclure que le
génotype DD (ou l'allèle D) est prédisposant à l'IDM. Ces résultats nous
permettent également de suspecter une susceptibilité à l'IDM chez le sexe
masculin dans la population Tunisienne. Toutefois, d'autres études seront
nécessaires par exemple le dosage
de l'activité de l'ECA afin de mieux comprendre les relations éventuelles entre
les différents facteurs de risque et le gène de l'ECA et par conséquent celles
de l'athérosclérose artérielle afin de conclure quant à la valeur morbide de ce
polymorphisme.
Références Bibliographiques
Bautista, L., E.,
Ardila, M., E., Gamarra, G., Vargas, C., I., Arenas, I., A., 2004,
Angiotensin-converting enzyme gene polymorphism and risk of myocardial
infarction in Colombia. Med. Sci. Monit., 10(8), CR 473-9.
Cambien, F.,
1994, The angiotensin-converting enzyme (ACE) genetic polymorphism: its
relationship with plasma ACE level and myocardial infarction.Clin. Genet., 46,
94-101.
Cambien, F.,
Costerousse, O., Tiret, L., Poirier, O., Lecerf, L., Gonzales, M., F., Ecans,
A., Arveiler, D., Cambon, J., P., Luc, et al., 1994, Plasma level and gene
polymorphisme of angiotensine-converting enzyme in relation to myocardial
infarction. Circulation, 90, 669-76.
Cambien, F.,
Poirier, O., Lecerf, L., Evans, A., Cambou, J., P., Arveiler, D., Luc, G., Bard
J., M., Bara, L., Ricard, S., et al., 1992, Deletion polymorphism in the gene
for angiotensin-converting enzyme is a potent risk factor for myocardial
infarction. Nature, 359, 641-4.
Cambien, F.,
Soubrier, F., 1995, The angiotensin-converting enzyme: molecular biology and
implication of the gene polymorphism in cardiovascular diseases.
Hypertension:Pathophysiology, Dignosis, and Management, Second Edition.
Filippi-Codaccioni,
E., Denizet, A., Fradin, S., Grollier, G., Morello, R., Hamon, M., 2004,
Genetic polymorphism of the angiotensin I converting enzyme and morbi-mortality
after myocardial infarction. Arch. Mal. Coeur Vaiss. Jan., 97(1),15-9.
Friedl, W.,
Krempler, F., Paulweber, B., Pichler, M., Sandhofer, F., 1995, A deletion
polymorphism in the angiotensin-converting enzyme gene is not associated with
coronary heart disease in an australian population. Atherosclerosis, 112 (2),
137- 143.
Fukazawa, R.,
Sonobe, T., Hamamoto, K., Hamaoka, K., Sakata, K., Asano T., Imai, T.,
Kamisago, M., Ohkubo, T., Uchikoba, Y., Ikegami, E., Watanabe, M., Ogawa, S.,
2004, Possible Synergic Effect of Angiotensin-I Converting Enzyme Gene
Insertion/Deletion Polymorphism and Angiotensin-II Type-1 Receptor 1166A/C Gene
Polymorphism on Ischemic Heart Disease in Patients with Kawasaki Disease.
Pediatr. Res., 56(4), 597-601.
Ganz, P.,
Creager, M., A., Fang, J., C., McConnell, M., V., Lee, R., T., Libby, P.,
Selwyn, A., P., 1996, Pathogenic mechanisms of atherosclerosis. Effect
of lipid lowering on the Biology of atherosclerosis. Am. J. Med.,
101(4A), 4A10S-16S.
Gardemann, A.,
Nguyen, Q., D., Humme, J., Stricker, J., Katz, N., Tillmanns, H., Hehrlein, F.,
W., Rau, M., Haberbosch, W., 1995, Deletion allele of
angiotensin-converting enzyme gene with myocardial infarction. Eur. Heart.
J., 19, 1657-1665.
Holmer, S R.,
Bickeboller, H., Hengstenberg, Rohlmann, F., Engel, S., Lowel, H., Mayer B,
Erdmann, J., Baier, C., Klein, G., Riegger, G A., Scunkert, H., 2003,
Angiotensin converting enzyme gene polymorphism and myocardial infarction: a
large association and linkage study. Int. J. Biochem. Cell. Biol., 35, 955-62.
Hooper, W., C.,
Dowling, N., F., Wenger, N., K., Dilley, A., Ellingsen, D., Evatt, B., L.,
2002, Relationship of venous thromboembolism and myocardial infarction with the
renin-angiotensin system in African-Americans. Am. J. Hematol., 70(1), 1-8.
Ishigami, T.,
Iwamoto, T., Tamura, K., Yamaguchi, S., Iwasawa, K., Uchino, K., Umemura, S.,
Ishii, M., 1995, Angiotensin I converting enzyme (ACE) gene polymorphism and
essential hypertension in japan, Ethnic differences of ACE genotype. Am. J.
Hypertens., 8, 95-97.
Karaali, Z., E.,
Agachan, B., Yilmaz, H., Isbir, T., 2004, Angiotensin-converting enzyme I/D
gene polymorphisms and effects of left ventricular hypertrophy in Turkish
myocardial infarction patients. Acta. Cardiol., 59(5), 493-7.
Katsuya, T.,
Koike, G., Yee, T., W., Sharpe, N., Jackson, R., Norton, R., Horiuchi, M.,
Pratt, R., E., Doan, V., J., MacMahon, S., 1995, Association of angiotensinogen
gene T235 variant with increased risk of coronary heart disease. Lancet, 345,
1600-1603.
Libby, P., 2002, Les maladies
cardio-vasculaires. Pour la Science, 296, 60-6.
Mata-Balaguer T.,
de la Herran R., Ruiz-Rejon, C., Ruiz-Rejon, M., Garrido-Ramos, MA.,
Ruiz-Rejon, F., 2004, Angiotensin-converting enzyme and p22(phox) polymorphisms
and the risk of coronary heart disease in a low-risk Spanish population. Int.
J. Cardiol., 95(2-3), 145-51.
Mendonca, I.,
Freitas, I., A., Sousa, C., A.,
Gomes, S., Faria, P., Drumond, A., Silva G., Araujo, J., J., Freitas, S.,
Ornelas, I., Andrade, G., Coelho, A P., Silva, P., M., Cardoso, A., Brehm, A.,
A., Dos Reis, R., P., 2004, Angiotensin converting enzyme gene polymorphisms
and coronary risk in a Portuguese population. Rev. Port. Cardiol., 23(12),
1593-601.
Petrovic, D.,
Bregar, D., Guzic-Salobir, B., Skof, E., Span, M., Terzic, R., Petrovic, M.,
G., Keber, I., Letonja, M., Peterlain, B., 2004, sex difference in the effect
of ACE-DD genotype on the risk of premature myocardial infarction. Angiology,
55 (2), 155-8.
Ranjith, N.,
Pegoraro, R., J., Rom, L., Lanning, P., A., Naidoo, D., P., 2004,
Renin-angiotensin system and associated gene polymorphisms in myocardial
infarction in young South African Indians. Cardiovasc. J. S. Afr., 15(1), 22-6.
Rigat, B.,
Hubert, C., Alhenc-Gelas, F., Cambien, F., Corrvol, P., Sourbier, F., 1990, An
insertion/deletion polymorphism in the angiotensin I-converting enzyme
gene accounting for a half the
variance of serum enzyme levels. J. Clin. Invest., 86,1343-6.
Samani, N., J.,
Thompson, J., R., O'Toole, L., Channer, K., Woods, K., L., 1996, A
meta-analysis of the association of the deletion allele of
angiotensin-converting enzyme gene with myocardial infarction. Circulation, 94,
708-12.
Sayed-Tabatabaei,
F., A., Schut, A., F., C., Arias Vásquez, A., Bertoli-Avella, A., M., Hofman,
A., Witteman, J., C., M., et van Duijn, C., M., 2005, Angiotensin converting
enzyme gene polymorphism and cardiovascular morbidity and mortality: the
Rotterdam Study . Journal of Medical Genetics, 42, 26-30.
Sobstyl, J., Dzida, G., Puzniak, A.,
Mosiewicz, J., Hanzlik, J., 2002, Angiotensin- converting enzyme gene insertion
/deletion polymorphism in Polish patients with myocardial infarction. Ann.
Univ. Mariae Curie Sklodowska , 57 (2), 21-8.
Sourbier, F.,
Alhenc-Gelas, F., Hubert, C., et al., 1988, Two putative active centers in
humains angiotensin I-converting
enzyme revealed by molécular cloning. Proc. Nath. Acad. Sci. USA, 85, 9386-90.
Vigen, C., Hodis, H., N., Selzer, R., H., Mahrer, P., R., Mack, W., j., 2005, Relation of regresion of coronary artery atherosclerosis to risk of cardiovascular events (from the Monitored Atherosclerosis Regression Study). Am. J. Cardio., 95 (11), 1277-82.
Winkelmann, B., R., Nauck, M., Klein,
B., Russ, A., P., Bohm, B., O., Siekmeier, et al., 1996, Deletion polymorphism
of the angiotensin I-converting enzyme activity but not with increased risk for
myocardial infarction and coronary disease. Ann. Inter. Med., 125, 19-25.